
- •Выбор места контроля загрязнения и поиск его источника с целью первичной оценки и отбора проб.
- •Пробоподготовка в анализе объектов окружающей среды
- •20 См) нанесены риски. Проба отбирается вращением пробоотборника за рукоятку против часовой стрелки с
- •Отбор проб донных отложений
- •Отбор проб растительности.
- •6. Отбор проб животного происхождения
- •Стабилизация, хранение, и транспортировка проб для анализа.
- •Особенности хранения биологических проб.
- •Отбор проб объектов загрязненной среды. Отбор проб воды.
- •Пробы из рек и водных потоков.
- •Пробы из природных и искусственных озер (прудов).
- •Пробы влажных осадков (дождя и снега).
- •Пробы грунтовых вод.
- •14. Пробы воды из водопроводных сетей.
- •Отбор проб воздуха. Отбор проб газа, способы и устройства для хранения газов.
- •4) Экстракция
- •Отбор проб в жидкие среды.
- •Отбор проб на твердые сорбенты
- •Криогенное концентрирование.
- •Хемосорбция.
- •24. Отбор проб в контейнеры.
- •25. Концентрирование на фильтрах.
- •26. Метод пробоподготовки сухое и мокрое озоление. Преимущества и недостатки.
- •Физико-химические методы в контроле загрязнения окружающей среды. Основные приборы и устройства для проведения анализов.
- •Экологическое нормирование. Критерии оценки качества окружающей природной среды. Нормы оценки загрязнения атмосферного воздуха, поверхностных вод и почв.
- •31.Электрохимические методы анализа
- •32. Вольтамперометрия.
- •Потенциометрические методы анализа.
- •Кислотно-основное титрование.
- •Комплексонометрическое титрование.
- •Титрование по методу осаждения.
- •Окислительно-восстановительное титрование .
- •Газовый анализ. Виды газового анализа: механические, акустические, тепловые, магнитные, оптические, ионизационные, масс-спектрометрические, электрохимические, полупроводниковые.
- •Микроскопия. Методы микроскопии.
- •Оптическая микроскопия.
- •Электронная микроскопия.
- •Рентгеновская микроскопия
- •Трансмиссионная микроскопия.
- •Растровая (сканирующая) микроскопия.
- •Сканирующая микроскопия.
- •Физические методы в мониторинге (масспектрометрия, рентгеноспектральный анализ).
- •Использование методов хроматографии в экологическом мониторинге. Способы расчета концентрации загрязняющих веществ.
- •Относится к оптическим методам анализа воды
- •Глобальные и региональные прогнозы состояния природной среды. Прогноз загрязнения природных вод, почв. Прогноз качества водных ресурсов.
- •Мониторинг за состоянием окружающей среды в местах хранения (накопления) отходов.
- •Глобальные и региональные прогнозы состояния природной среды. Прогноз загрязнения атмосферы.
Потенциометрические методы анализа.
Потенциометрический метод , основанный на измерении электродвижущих сил (э.д..с) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико-химических величин . В потенциометрии обычно применяют гальванический элемент, включающий два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса ) или в два различных по составу раствора , имеющих между собой жидкостной контакт (цепь с переносом). Электрод, потенциал которого зависит от активности (концентрации) определенных ионов в растворе , называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод , потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения.
В потенциометрии используют два основных класса индикаторных электродов:
1. Электроды, на межфазных границах которых протекают реакции с участием электронов. Такие электроды называют электронообменными. Их функционирование основано на зависимости равновесного потенциала от состава и концентрации исследуемого раствора , описываемой уравнением Нернста:
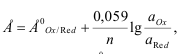
где Е – равновесный потенциал; Е0 – стандартный потенциал, равный равновесному, если активности всех участвующих в электрохимической реакции компонентов равны единице; n – число электронов, участвующих в полуреакции.
В основном это активные металлические электроды I рода (серебряный , медный , кадмиевый и др.) и инертные электроды (платиновый , золотой).
2. Электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными или ионообменными, а также ионоселективными (ИСЭ). Потенциал системы, состоящей из внешнего электрода сравнения и ИСЭ, погруженных в исследуемый раствор, описывается модифицированным уравнением Нернста (уравнение Никольского-Эйзенмана):
![]()
где const – константа, зависящая от значений стандартных потенциалов внутреннего и внешнего электродов сравнения и от природы мембраны ИСЭ; ai и zi, ak и zk – активности и заряды основного (потенциалопределяющего) и постороннего ионов соответственно; ki/kпот– потенциометрический коэффициент селективности ИСЭ по отношению к потенциалопределяющему иону (i) в присутствии постороннего иона (k).
Классификация потенциометрических методов анализа. Различают прямую потенциометрию (ионометрию ) – непосредственное измерение равновесного потенциала и нахождение активности ионов в растворе , и косвенную – потенциометрическое титрование – регистрация изменения потенциала в процессе химической реакции между определяемым веществом и титрантом. В потенциометрическом титровании используют реакции основных типов: кислотно-основные , окислительно-восстановительные и комплексообразования, а также прцессы осаждения. Индикаторный электрод выбирают в зависимости от типа химической реакции и природы потенциалопределяющих ионов.
34. Потенциометрическое титрование. Виды потенциометрического титрования.
Потенциометрическое титрование основано на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым компонентом и титрантом. Конечную точку титрования (к.т.т.) находят по скачку потенциала, отвечающему моменту завершения реакции.
Потенциометрическая индикация к.т.т., как и визуальная, преследует чисто прикладную цель – количественное определение содержания анализируемого вещества. Но по сравнению с последней потенциометрический метод обладает рядом несомненных преимуществ:
1) как инструментальный метод исключает субъективные ошибки, связанные с визуальным установлением к.т.т .;
2) более чувствителен , т.е. при той же величине погрешности можно снизить нижний предел определяемых концентраций;
3) позволяет осуществлять титрование в мутных и окрашенных средах;
4) дает возможность при определенных условиях дифференцированно (последовательно) определять компоненты из одной пробы;
5) легко поддается автоматизации процесса титрования.
К недостаткам потенциометрического титрования можно отнести не всегда быстрое установление потенциала после добавления титранта и необходимость во многих случаях проводить при титровании большое количество отсчетов.
Виды потенциометрического титрования . Подобно титриметрии с визуальным обнаружением к.т .т ., в потенциометрии могут быть использованы все четыре типа химических реакций: кислотно-основные , осаждения, комплексообразования и окисления- восстановления. К химическим реакциям , применяемым в потенциометрическом титровании, предъявляют те же требования, что и в обычном титриметрическом методе.
Методы потенциометрического титрования. В области к.т.т. происходит замена электрохимической (индикаторной) реакции на другую, что сопровождается скачком потенциала. Исходя из различной степени поляризации электродов и характера обратимости исследуемых систем , можно рекомендовать преимущественное применение в каждом конкретном случае одного из двух методов потенциометрического титрования:
- для определения компонентов обратимых систем успешно применяется классическая потенциометрия в отсутствии тока в цепи;
- для необратимых систем (или когда в испытуемом растворе присутствует лишь один компонент обратимой системы в отсутствии сопряженной формы) более приемлема потенциометрия с контролируемым током.
