
- •22. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
- •23. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
- •24. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
- •25. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
- •26. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
- •27. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
- •29. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
1. ТДС-это выделенное в качестве объекта изучения группа макротел или же его часть. Контрольная поверхность-это поверхность ограничивающая ТДС от др. тел ОС. Ближняя ОС-это ОС прилегающая к контрольной поверх., а остальная –дальняя ОС, к-я характеризуется параметрами имеющими индекс О. Рабочее тело-это тело, посредством к-го производится взаимное превращение теплоты и работы. Внутренние параметры характеризуют внутреннее состояние системы. К ни относят P ,T, V и др. Внешние параметры характеризуют положение системы(координаты) во внешних силовых полях и её скорость. Параметром состояния является абсолютная температура, выраженная в Кельвинах. Уравнение, устанавливающее связь между P, T и уд. объёмом среды постоянного состава, наз-ся термическим уравнением состояния: f(p,v,T)=0. Под термодинамическим процессом понимается совокупность последовательных состояний, через к-ые проходит ТДС при её взаимодействии с ОС. Равновесным наз-ют такое состояние системы, при к-ом во всех точках её объёма все параметры состояний и физические свойства одинаковы(P ,T, уд. объём ). Все процессы, происходящие в ТДС, подразделяются на равновесные и неравновесные.
Равновесными наз-ют такие процессы, когда система в ходе процесса проходит ряд последовательных равновесных состояний. Неравновесными наз-ся такие процессы, при протекании к-ых система не находится в состоянии равновесия. Все реальные процессы, протекающие в природе, являются неравновесными. В термодинамике рассматриваются процессы адиабатный, совершающийся при отсутствии теплообмена и политропный, обобщающий процесс, частными случаями к-го являются изохорный, изобарный и изотермический процессы. Системы, обладающие двумя степенями свободы (термической и деформационной), называют простыми или термодеформационными.
2. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
pv=RT. Это ур-ие связывает м/у собой параметры состояния газа(p, v и T) и называется уравнением состояния идеального газа или ур-ем Клайперона.
pV=mRT-ур-ие для произвольной массы газа.
pvM=MRT-ур-ие для 1кмоля. MR=R0, vM=Vm
pVm=R0T- наиболее общее ур-ие состояния ид.газа или ур-ие Менделеева или Клайперона-Менделеева. R0-универсальная газовая постоянная.
4. Внутренняя
энергия-это энергия, заключённая в
системе. Она состоит из кинетической
энергии поступательного, вращательного
и колебательного движения молекул,
потенциальной энергии взаимодействия
молекул, энергии движений частиц.
Вн.энергия является функцией внутренних
параметров состояния(T,P)
и состава системы. Изменение
![]() U
не зависит от формы пути процесса, а
определяется лишь её значениями в
конечном и начальном состояниях.
U
не зависит от формы пути процесса, а
определяется лишь её значениями в
конечном и начальном состояниях.
5. Передача энергии в результате макроскопического упорядоченного движения называется работой (механической или немеханической). Количество передаваемой при этом энергии называют работой процесса или просто работой.
Простейшим, наиболее наглядным видом работы является механическая работа, совершаемая механической силой, к-ая перемещает в пространстве макроскопическое тело или некоторую его часть. Сумму технической работы, изменения кинетической энергии и изменения потенциальной энергии называют располагаемой работой l0 :
l0 = lТ + (w2/2) + (gy),
Элементарная располагаемая работа определяется произведением объема на изменение давления с обратным знаком, т.е. dl0= - vdp.
В конечном
процессе располагаемая работа находится
интегрированием
![]()
Над рабочим телом, поступающим в систему, должна быть совершена некоторая работа внешней силой, работа ввода(проталкивания), которая увеличивает полную энергию системы. При выводе рабочего тела из системы ею должна затрачиватьcя работа по преодолению давления внешней среды – работа вывода рабочего тела. Работа ввода- вывода равна произведению давления на объем(Аввода =pV). Электрическая работа совершается, когда некоторое количество носителей электрического заряда переносится в электрическом поле(dLэл=-Еэлdlэл). При совершении магнитной работы происходит организованный, соответствующий ориентации магнитного поля поворот в пространстве всех элементарных магнитов, присутствующих в намагничиваемом материале(dLмаг = -НмагdМмаг).
6. Все виды энергии в конечном счёте превращаются в теплоту, к-ая затем рассеивается в окружающей среде. Мера этого рассеивания была названа энтропией. Чем больше рассеивается(обесценивается) энегия, тем больше увеличивается энтропия. Энтропия является неотъемлемым свойством материи, причём энтропия-мера рассеивания(деградации) энергии. Энтропия представляет собой параметр, определяющий состояние газа и являющийся функцией состояния.
7. На рис.показана фазовая P-V-диаграмма, к-ая представляет собой график зависимости удельного объёма воды и водяного пара от давления. При нагреве воды при нек-ом постоянном давлении удельный объём будет увеличиваться и при достижении температуры кипения в точке А(штрих) удельный объём жидкости становится максимальным. С увеличением давления температура кипения возрастает и удельный объём в точке А(2штриха) будет больше, чем в точке А(штрих).

Удобство T-S-диаграммы в том, что она позволяет проследить изменение температуры рабочего тела и находить количество теплоты, участвующие в процессе. К неудобствам диаграммы следует отнести необходимость измерения соответствующих площадей. T-S-диаграмма широко применяется при исследовании паросиловых и холодильных установок, обеспечивая наиболее наглядное изображение процессов.

8. Одной из энергетических характеристик ТДС является тепловая функция, или энтальпия. Энтальпия или энергия расширенной системы, E равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом pV. Энтальпия имеет вполне определённое значение для каждого состояния, т.е. является функцией состояния. Энтальпией системы удобно пользоваться в тех случаях, когда в качестве независимых переменных, определяющих состояние системы, выбирают давление p и T. Энтальпия-величина аддитивная, т.е. для сложной системы равна сумме энтальпий её независимых частей.
9. Каждое равновесное состояние ТДС характеризуется определёнными физическими величинами-равновесными параметрами состояния. Внутренние параметры характеризуют внутреннее состояние системы. К ним относят давление, температура, объём и др. Внешние параметры характеризуют положение системы(координаты) во внешних силовых полях и её скорость. Внутренние параметры разделяют на интенсивные и экстенсивные. Интенсивные-это те параметры, величина к-ых не зависит от размеров(массы) тела(P T уд. объём, но не объём, уд. теплоёмкость). Экстенсивные параметры зависят от количества вещества в системе(объём, масса и др.).
10. В открытой ТДС изменение энергии связано с обменом веществом между системой и ОС.
![]()
Это уравнение справедливо для как для стационарных, так и нестационарных процессов вследствие того, что все дифференциалы относятся ко времени как к независимой переменной. Для стационарных открытых систем dU=0, dm=0, т.е. энергия, накопленная открытой системой, остаётся неизменной, а её масса постоянна.
11. Теплоёмкостью называется количество теплоты, которое нужно подвести к телу или отнять то него для изменения температуры тела на 1градус. Теплоёмкость вычисляется по формуле:
![]() [ДЖ/К].
Удельная теплоёмкость равна отношению
теплоёмкости однородного тела к его
массе:
[ДЖ/К].
Удельная теплоёмкость равна отношению
теплоёмкости однородного тела к его
массе:![]() [ДЖ/кг.К].
Объёмной теплоёмкостью называется
отношение теплоёмкости тела к его объёму
при нормальных физических условиях:
[ДЖ/кг.К].
Объёмной теплоёмкостью называется
отношение теплоёмкости тела к его объёму
при нормальных физических условиях:
![]()
В ряде случаев за
единицу количества вещества удобно
принимать такое его количество вещества,
к-ое равно молекулярному весу этого
вещества. В этом случае пользуются
мольной или молярной теплоёмкостью:![]()
Также есть теплоёмкости при постоянном объёме и давлении, массовые теплоёмкости при постоянном объёме и давлении, истинная теплоёмкость:
12. В
практических расчётах теплоёмкости
![]() и
и
![]() газов
обычно записываются в виде 2
слагаемых:
газов
обычно записываются в виде 2
слагаемых:![]() ;
;![]() Первое
слагаемое в обеих формулах – теплоёмкость
идеального газа, подчиняющихся уравнению
Первое
слагаемое в обеих формулах – теплоёмкость
идеального газа, подчиняющихся уравнению
![]() при
p=0,
причём
при
p=0,
причём
![]() является
величиной не постоянной, а зависящей
от температуры. Второе слагаемое
орпеделяет зависимость теплоёмкости
от давления.
является
величиной не постоянной, а зависящей
от температуры. Второе слагаемое
орпеделяет зависимость теплоёмкости
от давления.
Уравнение Майера:
![]()
13. Газовой
смесью называется смесь отдельных
газов, химически не реагирующих между
собой, т.е. каждый газ в смеси полностью
сохраняет все свои свойства и занимает
весь объём смеси. Параметры газовой
смеси могут быть вычислены по уравнению
Клайперона pV=mRT.
Газовая смесь может быть задана массовыми,
объёмными и молярными долями. Когда
газовая смесь задана массовым составом,
то из у-ия состояния получим:
![]() По
известной газовой постоянной смеси
можно найти молекулярный вес смеси.
По
известной газовой постоянной смеси
можно найти молекулярный вес смеси.
14. Параметры газовой смеси могут быть определены по уравнению Клайперона:
![]()
Так как
![]() ,
то молекулярный вес смеси
,
то молекулярный вес смеси
![]() будет определяться по формуле:
будет определяться по формуле:
 Полученное
значение называется средним кажущимся
значением молекулярного веса смеси.
Знание молекулярного веса позволяет
по формуле R=8,3143/
находить
газовую постоянную смеси R.
Полученное
значение называется средним кажущимся
значением молекулярного веса смеси.
Знание молекулярного веса позволяет
по формуле R=8,3143/
находить
газовую постоянную смеси R.
15. Утверждение о невозможности получения работы за счёт энергии тел, находящихся в термодинамическом равновесии, составляет основное положение второго закона термодинамики. Второй закон термодинамики позволяет указать направление теплового потока и устанавливает максимально возможный предел превращения теплоты в работу в тепловых машинах. Теплота не может самопроизвольно переходить то менее нагретого тела к более нагретому. Всякая изолированная система с течением времени приходит в равновесное состояние, к-ое остаётся неизменным до тех пор, пока система не будет выведена из него внешним воздействием.
17. 2-й з-н термод. позволяет указать направление теплового потока и устанавливает максимально возможный предел превращения теплоты в работу в тепл.машинах.
а) Имеется подвод и отвод теплоты
![]()
Данное выражение явл. формулировкой 2 з. термод., энтропия увелич..
б) Воздействие в форме работы
![]()
в) теплота+работа

18. 2-й з. т/д в формулировке Больцмана:
Любая ТДС переходит с течением времени из состояния менее вероятного в состояние более вероятное.

В целом применительно к любым т/д системам, можно констатировать принцип роста энтропии, как сущность 2 закона термодинамики.
В любых необратимых процессах энтропия увеличивается.
19. Термические
коэффициенты характеризуют тепловые
и упругие свойства тел. Известны
коэффициент объёмного расширения
![]() ,
термический коэффициент давления
,
термический коэффициент давления
![]() и изотермический коэффициент сжимаемости
и изотермический коэффициент сжимаемости
![]() .
.
Относительное
изменение объёма при нагревании на 1
градус называется коэф. объёмного
расширения:
![]() Для
идеального газа:
Для
идеального газа:
![]() .Если
нагревать данную массу вещества при
постоянном объёме, то относительное
изменение давления при изменении
температуры характеризуется величиной
термического коэф. давления
.Если
нагревать данную массу вещества при
постоянном объёме, то относительное
изменение давления при изменении
температуры характеризуется величиной
термического коэф. давления
![]() При
изотермическом сжатии данной массы
вещества отношение изменения объёма
при изменении давления на 1 единицу
давления к объёму называется изотермическом
коэф. сжимаемости:
При
изотермическом сжатии данной массы
вещества отношение изменения объёма
при изменении давления на 1 единицу
давления к объёму называется изотермическом
коэф. сжимаемости:
![]() Знак
минус означает уменьшение объёма с
увеличением давления.
Знак
минус означает уменьшение объёма с
увеличением давления.
20. Реальные газы отличаются от идеальных тем, что их молекулы имеют конечные собственные объёмы и связаны между собой силами взаимодействия, имеющими электромагнитную и квантовую природу. С увеличением расстояния между молекулами силы взаимодействия уменьшаются. Наиболее простым и качественно верно отображающим изменение состояния реального газа является ур-ие Ван-дер-Ваальса:
![]()
к-ое является
частным случаем общего ур-ия состояния
Майера-Боголюбова. Количество теплоты,
затрачиваемое в процессе при p=const
на превращение 1 кг жидкости при
температуре кипения в сухой насыщенный
пар той же температуры, наз-ся теплотой
парообразования и обозначается r.
Разность внутренних энергий, затрачиваемых
на работу против внутренних сил, наз-ся
внутренней теплотой парообразования(![]() )
Теплота, затрачиваемая на работу против
внешних сил наз-ся внешней теплотой
парообразования (
)
Теплота, затрачиваемая на работу против
внешних сил наз-ся внешней теплотой
парообразования (![]() ).
).
21. Если сжимать газ при постоянной температуре, то можно достигнуть состояния насыщения. При дальнейшем сжатии пар будет конденсироваться и в определённый момент полностью превратится в жидкость. Если на p-v диаграмме построить изотермы, соответствующие ур-ию Ван-дер-Ваальса, то они будут иметь вид кривых, изображённых на рис.

Действительный переход из жидкого в газообразное состояние изображается прямой линией(изобарой AB). При сравнительно низких температурах кривые имеют в средней части волнообразный характер с максимумом и минимумом. При этом, чем выше T, тем короче волнообразная часть изотермы. Для графического изображения процессов, происходящих в паре, удобно пользоваться Ts-диаграммой, ибо в ней площадь под кривой обратимого процесса даёт количество теплоты, сообщаемое телу или отнимаемое от него.
22. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
Политропным
называется процесс, в к-ом уд. Теплоёмкость
остаётся постоянной величиной, а линию
процесса называют политропой. Политропы-это
кривые, описывающие газовые процессы,
в к-ых происходит изменение всех
термодинамических параметров. Уравнение
политропного процесса:
![]() ,
где n-показатель
политропы. Он изменяется в пределах от
–беск. до +беск.
,
где n-показатель
политропы. Он изменяется в пределах от
–беск. до +беск.
23. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
Изобарным называется процессы, протекающие при постоянном давлении. Кривые процессов называются изобарами.

Уравнение процесса: p=const или dp=0. В изобарном процессе часть теплоты, подведённой к рабочему телу, расходуется на изменение внутренней энергии, а оставшаяся часть идёт на совершение внешней работы. Все изобары являются эквидистантными кривыми, имеющими при одной и той же температуре одинаковые угловые коэффициенты.
24. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
Изотермическим называется процесс, протекающий при постоянной температуре. Кривая процесса называется изотермой.

Уравнение процесса: T=const или dT=0, pv=const.
В изотермическом процессе идеального газа работа изменения объёма L, располагаемая работа L0 и удельное количество теплоты равны между собой L=L0=q.
25. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
Изохорным называется процесс, проходящий при постоянном объёме. Кривая процесса называется изохорой.

Уравнение процесса: v=const или dv=0.
Закон Шарля:
![]()
При изохорном процессе изменение абсолютных давлений прямо пропорционально изменению абсолютных температур. Используя кривую изохорного процесса в Ts-координатах, можно определить значение истинной теплоёмкости.
Изохоры при различных объёмах являются эквидистантными кривыми, имеющими при одной и той же температуре одинаковые угловые коэффициенты.
26. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
Адиабатным называется процесс, протекающий без теплообмена с окружающей средой. Кривая этого процесса называется адиабатой.

Уравнение адиабатного
процесса: dQ=0
и
![]()
![]()
В адиабатном процессе работа совершается за счёт убыли внутренней энергии. Изменение энтропии в адиабатном процессе ds=0, то есть обратимый адиабатный процесс одновременно является изоэнтропным (при постоянной энтропии).
27. Идеальный газ-это газ, в к-м отсутствуют силы взаимодействия между молекулами, а сами молекулы, имеющие массу, рассматриваются как материальные точки, не имеющие объёма.
Показатель политропы
n
изменяется в пределах от –беск. до
+беск. Теплоёмкость в политропном
процессе определяется по формуле:
![]() С
помощью этой формулы можно проследить
за изменением теплоёмкости рабочего
тела в политропном процессе в зависимости
от показателя политропы
С
помощью этой формулы можно проследить
за изменением теплоёмкости рабочего
тела в политропном процессе в зависимости
от показателя политропы
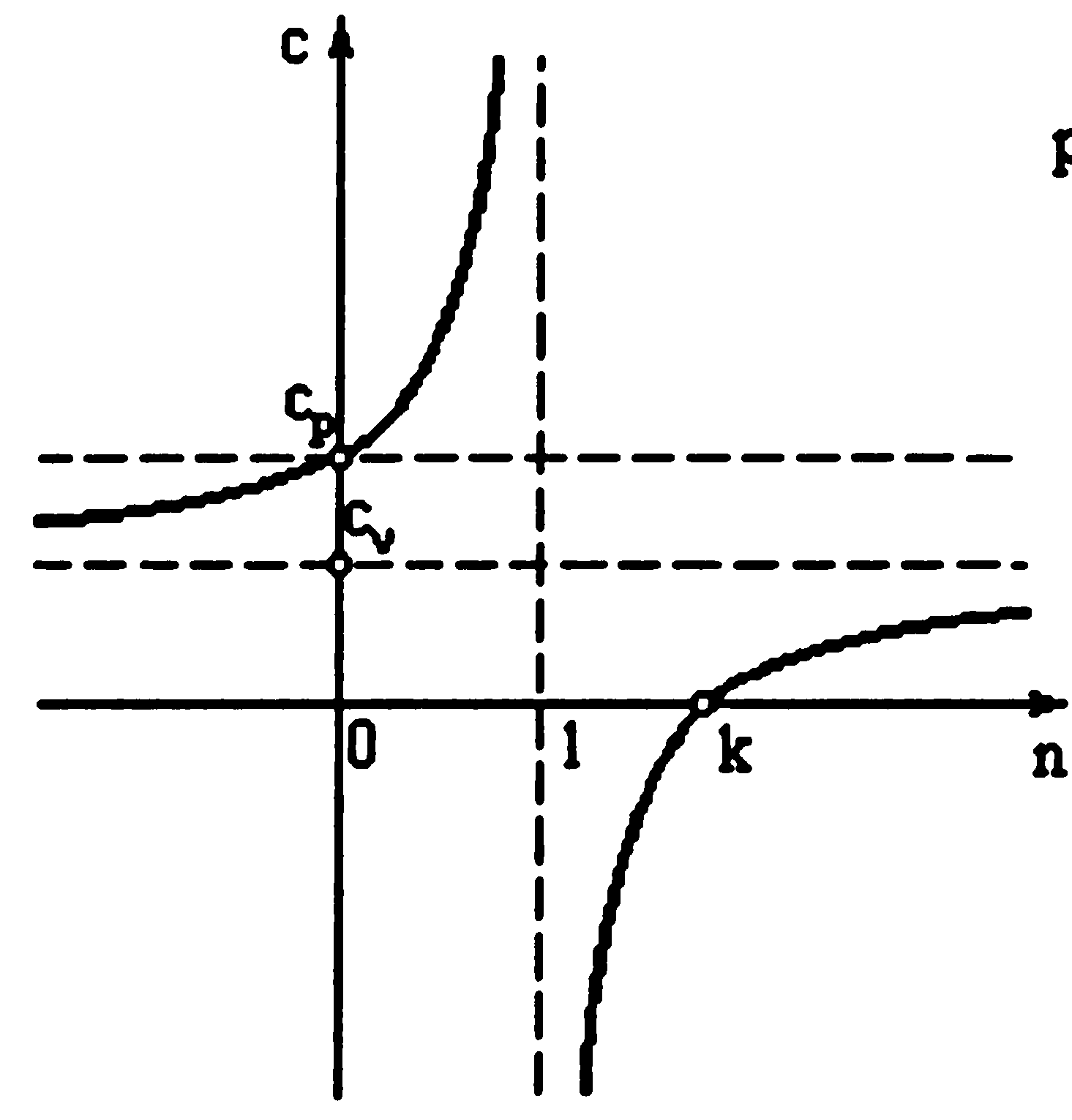
Анализ графика показывает, что в диапазоне изменения показателя политропы 1<n<k теплоёмкость оказывается отрицательной. Это связано с тем, что при подводе теплоты к рабочему телу температура его снижается, а при отводе теплоты - повышается.
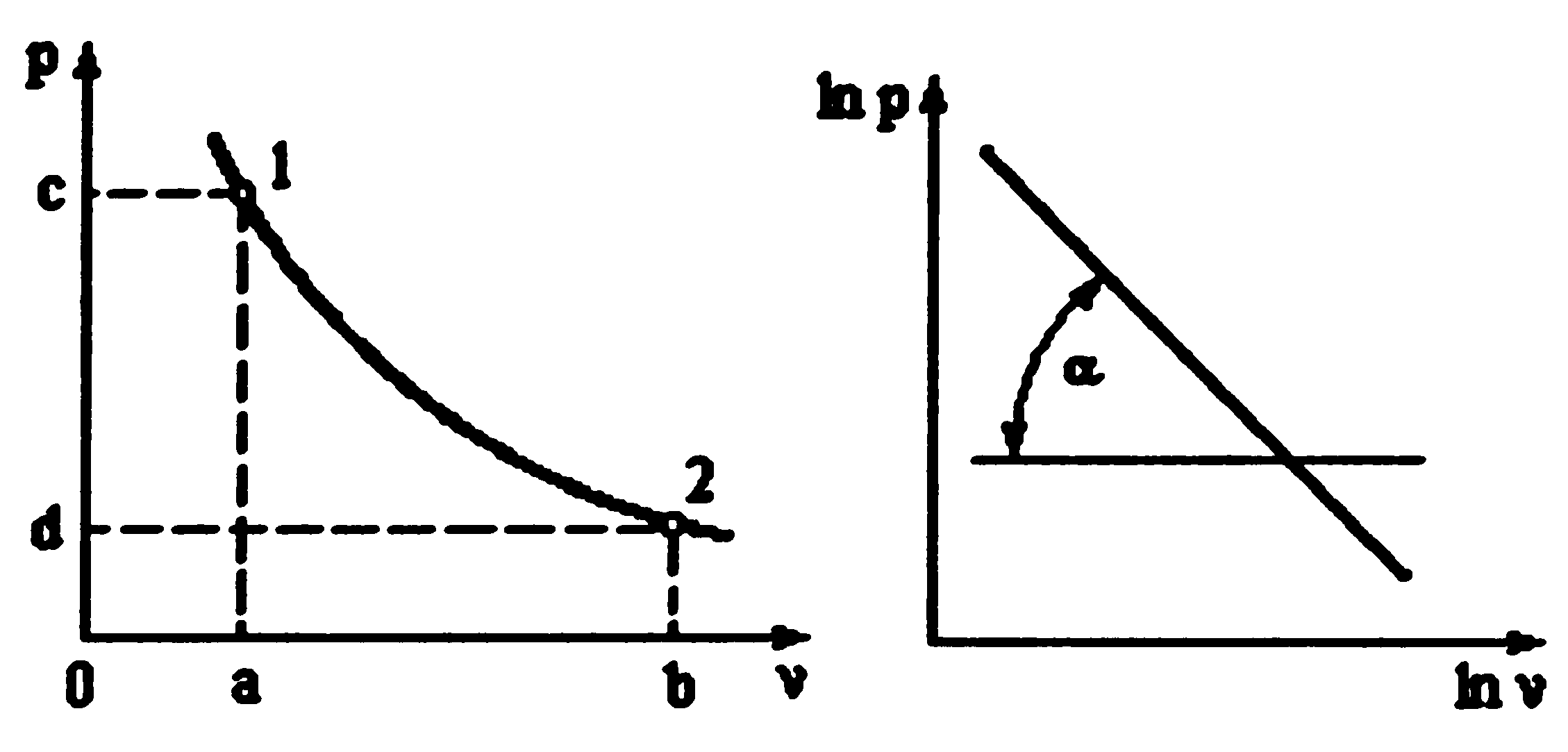
Способы: 1). 2).
2).![]()
3).
![]() ,
где
-угол
наклона политропы в логарифмических
координатах.
,
где
-угол
наклона политропы в логарифмических
координатах.
