
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методи захисту від корозії.
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
Дайте визначення σ- та π-зв’язку. Приведіть приклади.
Який фізичний смисл константи швидкості хімічної реакції. Вкажіть фактори, які впливають на швидкість хімічної реакції. Залежність швидкості хімічної реакції від температури – правило Вант-Гоффа.
Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
![]()
Для нейтралізації 50 мл 0,1 н розчину NaOH потрібно 10 мл розчину H2SO4. Визначте молярну концентрацію еквіваленту цього розчину.
Розрахуйте ступінь дисоціації оцтової кислоти в 0,25 М розчині. Кд СН3СООН дорівнює 1,8∙10-5.
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
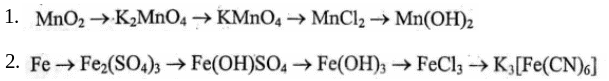
Розрахуйте потенціал хромового електрода в розчині його солі з концентрацією іонів Cr3+ = 0,03 моль/л. Е0 Cr3+/Cr = -0,744 B.
Хімічні властивості бору.
Хімічні властивості та методи добування лужних металів. Їх використання у промисловості та техніці.
Визначити масову частку (%) сульфатної кислоти у 2 н розчині (ρ = 1,065 см3).
Зав. кафедрою ЕТП,
д.х.н., професор Задорожний В.Г..
Викладач Клименко І.П..
Протокол засідання кафедри ЕТП № 11 від 5 квітня 2009 р.
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 7
Дайте визначення поняття гібридизації атомних орбіталей. Поясніть причину та механізм гібридизації, а також вплив типу гібридизації на просторову будову молекули. Приведіть приклади.
Сформулюйте принцип Ле-Шательє. Перерахуйте фактори, які приведуть до зміщення рівноваги вліво:
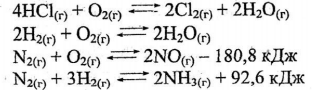
Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
Na2SO3 + KIO3 + H2SO4 → Na2SO4 + I2 + K2SO4 + H2O;
CrCl3 + H2O2 + NаOH → Na2CrO4 + NaCl + H2O;
MnSO4 + PbO2 + HNO3 → HMnO4 + PbSO4 + Pb(NO3)2 + H2O;
Розставте коефіцієнти в окиснювально-відновних реакціях. Вкажіть окиснювач і відновник. Яка речовина окиснюється, яка відновлюється?
Розрахуйте масу карбонату натрію, яку потрібно для приготування 500 мл 0,1 н розчину. Обчислити титр цього розчину та масову частку карбонату натрію в цьому розчині, якщо ρ = 1,017 г/см3.
Розрахуйте [H+] та рН 0,01 М та 0,05 М розчинів H2SO4.
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
CaCl2 → Ca → CaO → Ca(OH)2 → CaCO3 → Ca(HCO3)2 → CaCO3 → CaCl2
CaO → Ca(OH)2 → Ca3(PO4)2 → H3PO4 → Na3PO4
Складіть схему гальванічного елемента, утвореного залізом та свинцем, зануреними в 0,01 М розчини їх солей. Розрахуйте ЕРС цього елемента. EoFe2+/Fe = -0,440 V, EoPb2+/Pb = -0,126 V.
Користуючись довідковими таблицями визначити, чи можлива при температурах 298˚ та 2500˚К реакція відновлення оксиду Титану (ІV) до вільного металу по схемі:
![]()
Хімічні властивості сполук хрому.
Що таке жорсткість води? Методи її визначення та усунення.
Зав. кафедрою ЕТП,
д.х.н., професор Задорожний В.Г..
Викладач Клименко І.П..
Протокол засідання кафедри ЕТП № 11 від 5 квітня 2009 р.
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 8
З позицій метода валентних зв’язків вкажіть, які електрони атому бору приймають участь в утворенні ковалентного зв’язку, визначіть тип гібридизації атомних орбіталей бору в молекулі BF3 та охарактеризуйте просторову будову цієї молекули. На основі метода ВС поясніть механізм утворення зв’язків в молекулі СО.
Запишіть математичні вирази констант рівноваги для систем:
![]()
Як зміниться рівновага обох систем якщо: а) підвищити тиск вихідних речовин; б) підвищити температуру; в) знизити концентрацію вихідних речовин.
