
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методи захисту від корозії.
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 21
Напишіть електронні та електронно-графічні формули атомів елементів з порядковими номерами 7,8,11,15,21,25,30. Сформулюйте та поясніть принцип Паулі та правило Хунда.
Вкажіть, чому дорівнює тепловий ефект ізобарного та ізохорного процесів. Дати визначення та пояснити суть першого закону термодинаміки.
Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник:
Na2Cr2O7 + HCl → Cl2 + CrCl3 + NaCl + H2O
KClO3 + HCl →
Визначити еквівалент окисника та відновника.
Обчисліть еквівалентну та молярну концентрації розчину азотної кислоти з масовою долею 20,8 % (ρ = 1,12 г/см3). Скільки грамів азотної кислоти міститься в 4 дм3 цього розчину?
Поясніть явище осмосу. Закон Вант-Гоффа.
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
Розрахуйте потенціал мідного електрода в розчині його солі з концентрацією іонів Cu2+ = 0,01 моль/л. Е0 Cu2+/Cu = 0,34 B.
Назвіть комплексні сполуки: [Pt(NH3)2Cl2]; [Co(NH3)5Br]SO4; K3[Fe(CN)6]; K4[Fe(CN)6]; Zn(NH3)4SO4; Na3[Co(NO2)6]. Визначити ступінь окиснення та координаційне число комплексоутворювача, напишіть рівняння первинної та вторинної дисоціації.
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
а) С02 → СОС12 → С02 → С → А14С3 → СН4;
б) Si → Na2Si03 → H4Si04 → Si02 → SiCl4 → K2Si03;
Розрахуйте стандартну зміну ентропії для реакції:
СаСО3(г) = СаО(г) + СО2(г)

Зав. кафедрою ЕТП,
д.х.н., професор Задорожний В.Г..
Викладач Клименко І.П..
Протокол засідання кафедри ЕТП № 11 від 5 квітня 2009 р.
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 2
Дайте визначення поняттю ковалентний зв'язок. Охарактеризуйте його параметри (енергія зв’язку, довжина зв’язку, валентний кут зв’язку) та властивості: насиченість, направленість, полярність та поризуємість. Приведіть приклади сполук з ковалентним типом зв’язку.
Сформулюйте закон Гесса. Вкажіть, чому дорівнює тепловий ефект ізобарного та ізохорного процесів. Дайте визначення поняття ентальпія.
Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник:
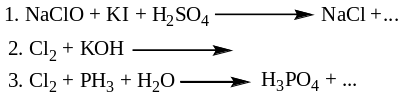
Чому дорівнює еквівалентна концентрація розчину NaOH з масовою долею 30 % (ρ=1,328 г/см3)? До 1 дм3 цього розчину додали 5 дм3 води. Обчисліть (ω, %) NaOH в отриманому розчині.
Закони Рауля. Фізичний смисл ебуліоскопічної та кріоскопічної константи. Що таке ізотонічний коефіцієнт? Його зв'язок з ступенем дисоціації.
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
Розрахуйте потенціал срібного електрода в розчині його солі з концентрацією іонів Ag+ = 0,01 моль/л. Е0 Ag+/Ag = 0,799 B.
Назвіть комплексні сполуки: [Fe(H2O)3(ClO4)(SCN)2]; [Cr(H2O)6]Cl3; K3[Ag(S2O3)2]; K4[Fe(CN)6]; Zn(NH3)4SO4; K[Ag(CN)2]. Визначити ступінь окиснення та координаційне число комплексоутворювача, напишіть рівняння первинної та вторинної дисоціації.
Методи захисту від корозії.
Хімічні властивості галогенів. Лабораторні та промислові методи отримання галогенів у вільному стані.
Зав. кафедрою ЕТП,
д.х.н., професор Задорожний В.Г..
Викладач Клименко І.П..
Протокол засідання кафедри ЕТП № 11 від 5 квітня 2009 р.
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 3
Дайте визначення поняття водневий зв'язок. Приведіть приклади сполук з водневим типом зв’язку.
Вкажіть умову самовільного перебігу процесу, використовуючи величину ізобарно-ізотерміного потенціалу. Дайте визначення поняттю ентропія.
Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
![]()
Визначити еквівалентну концентрацію розчину, отриманого при змішувані 2,0 дм3 0,5 н та 0,5 дм3 2,0 н розчинів.
Ступіть дисоціації та константа дисоціації. Зв'язок між ними. Закон Освальда.
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
