
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методи захисту від корозії.
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
- •Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
- •Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
Розрахуйте потенціал цинкового електрода в розчині його солі з концентрацією іонів Zn2+ = 0,01 моль/л. Е0 Zn2+/Zn = -0,763 B.
Назвіть комплексні сполуки: [Fe(H2O)3(ClO4)(SCN)2]; [Cr(H2O)6]Cl3; K3[Ag(S2O3)2]; K4[Fe(CN)6]; Zn(NH3)4SO4; K[Ag(CN)2]. Визначити ступінь окиснення та координаційне число комплексоутворювача, напишіть рівняння первинної та вторинної дисоціації.
Хімічні властивості марганцю. Будова його атома. Використання марганцю та його сполук у промисловості, техніці та медицині.
Методи захисту від корозії.
Зав. кафедрою ЕТП,
д.х.н., професор Задорожний В.Г..
Викладач Клименко І.П..
Протокол засідання кафедри ЕТП № 11 від 5 квітня 2009 р.
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 4
Поясніть фізичний смисл головного, орбітального, магнітного та спінового квантових чисел. Вкажіть, які значення вони приймають. Напишіть електронні формули іонів: Ca2+, Ag+, As3-, Cl7+,
Що таке енергія Гіббса. Як залежить зміна енергії Гіббса від величини зміни ентальпії та ентропії? Яка умова принципової можливості перебігу процесу?
Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
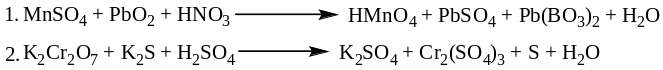
При розчиненні сірчаної кислоти масою 133,2 г одержали розчин (ρ=1,25 г/см3). Визначити: а) молярну концентрацію; б) еквівалентну концентрацію; в) масову долю (%) сірчаної кислоти в отриманому розчині.
Що таке іонний добуток води? Дайте визначення понять рН та рОН. Зв'язок між цими поняттями. Як залежить рН розчину кислоти чи основи від їх константи дисоціації?
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
Розрахуйте потенціал магнієвого електрода в розчині його солі з концентрацією іонів Mg2+ = 0,01 моль/л. Е0 Mg2+/Mg = -2,363 B.
Хімічні властивості Сіліцію. Методи його отримання. Найважливіші сполуки та їх використання.
Порівняйте будову атома та хімічні властивості Нітрогену та Фосфору.
Визначити масову долю (%) FeSO4 у розчині, який одержали при розчиненні FeSO4∙7Н2О масою 208,5 г у воді масою 129,5 г.
Зав. кафедрою ЕТП,
д.х.н., професор Задорожний В.Г..
Викладач Клименко І.П..
Протокол засідання кафедри ЕТП № 11 від 5 квітня 2009 р.
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 5
Дайте визначення поняття іонний зв'язок. Приведіть приклади сполук з іонним типом зв’язку. Напишіть електронні формули іонів: Fe3+, Fe2+, F-, Cl-, Zn2+, Cu2+.
Сформулюйте закон Гесса. Що таке ендотермічні та екзотермічні реакції? Який зв'язок між тепловим ефектом (ентальпією) реакції та ентальпіями утворення вихідних речовин та продуктів реакції?
Методом електронно-іонного балансу розставити коефіцієнти в рівняннях окиснювально-відновних реакцій, вказати окисник та відновник, визначити еквівалент окисника та відновника:
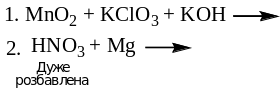
500 г розчину СоСl2 з масовою часткою 25 % упарюванням видалили 30 г води. Розрахуйте масову частку отриманого розчину, його молярну та нормальну концентрації та титр.
Визначити рН насиченого розчину гідроксиду кальцію при 25оС. ПРСа(ОН)2 =6,3∙10-6. Як залежить ступінь дисоціації електроліту від константи дисоціації?
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
Розрахуйте потенціал електрода з мангану в розчині його солі з концентрацією іонів Mn2+ = 0,02 моль/л. Е0 Mn2+/Mn = -1,179 B.
Як змінюються кислотний-основні властивості гідроксидів одного і того ж d-елементу залежно від його ступеня окислення?
Закон Освальда. Іонний добуток води. Що таке рН та рОН? Методи їх визначення.
Необхідно приготувати 500 мл розчину гідроксиду натрію з молярною концентрацією еквівалента 0,1 н. з розчину лугу з масовою часткою 13,28%, густиною ρ=1,145 г/см3. Який об’єм цього розчину треба взяти?
Зав. кафедрою ЕТП,
д.х.н., професор Задорожний В.Г..
Викладач Клименко І.П..
Протокол засідання кафедри ЕТП № 11 від 5 квітня 2009 р.
ОДЕСЬКИЙ ДЕРЖАВНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
Стаціонар
Хімія та методи дослідження сировини та матеріалів
Білет № 6
