
- •Частные случаи первого закона термодинамики для изопроцессов-
- •Гетерогенные реакции -это хим. Реакции с участием в-в, находящихся в различных фазах и составляющих в совокупности гетерогенную систему.
- •Правила составления ионных уравнений реакций-
- •Степень гидролиза
- •Измерение потенциалов
- •Вывод уравнения Нернста
- •Металлы и их физические свойства
- •Металлы и их химические свойства
Гетерогенные реакции -это хим. Реакции с участием в-в, находящихся в различных фазах и составляющих в совокупности гетерогенную систему.
Химическое равновесие в гетерогенных системах-Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением:
![]()
где fi — фугитивность компонентов газовой фазы, а ak — активность компонентов конденсированной фазы.
Если конденсированные фазы (твёрдые или жидкие) представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия (то есть в левую часть выражения выше). Условно можно принять их равными единице и, таким образом, исключить из выражения.
Химическое равновесие в гомогенных системах-
При равенстве энтальпийного и энтропийного факторов ΔН = ТΔS ΔG = 0, что является термодинамическим условием химического равновесия. Химическое равновесие имеет динамический характер. Скорость в прямом направлении равна скорости реакции в обратном направлении. В этот момент концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. Они обозначаются символом вещества в квадратных скобках.
5-9)Зависимость константы равновесия от температуры
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
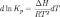
и изохоры химической реакции (изохоры Вант-Гоффа):
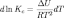
Здесь ΔH
и ΔU — тепловой эффект реакции,
протекающей, соответственно, при
постоянном давлении или при постоянном
объёме. Если ΔH > 0 (тепловой эффект
положителен, реакция эндотермическая),
то температурный коэффициент константы
равновесия
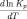 тоже
положителен, то есть с ростом температуры
константа равновесия эндотермической
реакции увеличивается, равновесие
сдвигается вправо (что вполне согласуется
с принципом Ле Шателье).
тоже
положителен, то есть с ростом температуры
константа равновесия эндотермической
реакции увеличивается, равновесие
сдвигается вправо (что вполне согласуется
с принципом Ле Шателье).
5-10) Принцип Ле Шателье — термодинамический принцип подвижного равновесия, который описывает влияние, которое оказывается на систему внешним воздействием и может быть сформулирован следующим образом:
Если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в таком направлении, которое способствует ослаблению этою воздействия.
Так, согласно принципу Ле Шателье, введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается и соответственно увеличивается концентрация продуктов его взаимодействия.Процесс будет идти до тех пор, пока система не придет к состоянию равновесия. В этом новом состоянии химического равновесия концентрации (парциальные давления) всех веществ отличны от начальных, но соотношение между ними, выражаемое констатой равновесия, остается тем же. Таким образом, в системе, находящейся в равновесии, нельзя изменить концентрацию какого-нибудь из реагентов, не вызывая изменения концентрации всех остальных.
6-1) Растворами называют гомогенные однородные системы, состоящие из двух и более компонентов, состав которых можно изменять в определенных пределах без нарушения однородности. С химическими соединениями их роднит однородность, другим общим признаком являются довольно значительные объемные и энергетические эффекты, сопровождающие процесс растворения многих веществ. Первые обширные работы по изучению растворов принадлежат М. В. Ломоносову. Различают растворы истинные и коллоидные. При образовании истинных растворов соединения распадаются на частицы очень маленького размера, т. е. растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Коллоидные растворы относятся к гетерогенным системам, в которых частицы одного вещества равномерно распределены в другом. Растворы бывают газообразными (газовые смеси), жидкими и твердыми. Газообразным раствором является, например, воздух. Морская вода - наиболее распространенный жидкий раствор различных солей и газов в воде. К твердым растворам относятся многие металлические сплавы. Наибольшее практическое значение имеют жидкие растворы. В этих растворах обычно протекает большинство реакций, так как в них создаются весьма благоприятные условия для перемещения молекул и тесного их сближения, необходимого для химического
взаимодействия.
6-2) Концентрация - это отношение массы растворенного вещества к массе раствора (массовая концентрация) или отношение количества вещества к объему раствора (молярная концентрация). Единицами этих концентраций служат соответственно г/л и моль/л. В аналитической практике используются также эквивалентная концентрация, равная отношению количества эквивалента вещества к объему раствора. Единицей этой концентрации является моль экв/л. Концентрация - это один из способов выражения состава раствора. Кроме того, состав раствора выражают через безразмерные относительные величины - доли. Объемная доля - отношение объема растворенного вещества к объему раствора; массовая доля – отношение массы растворенного вещества к массе раствора; мольная доля - отношение количества растворенного вещества (число молей) к суммарному количеству всех компонентов раствора. Существуют и другие способы выражения состава раствора. В частности, концентрацию вещества в растворах, используемых для титрования, часто представляют с помощью титра - число грамм растворенного вещества в 1 мл раствора. В термодинамике часто используют моляльную концентрацию и моляльность раствора. Моляльная концентрация - это число моль растворенного вещества, приходящееся на 1 кг растворителя; безразмерная величина, численно равная моляльной концентрации, называется моляльностью раствора, ее обозначают символом m.
6-3) Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Ненасыщенный раствор - раствор, содержащий меньше вещества, чем в насыщенном.
Перенасыщенный раствор - раствор, содержащий больше вещества, чем в насыщенном.
Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
6-4) При растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором.
Обозначим давление насыщенного пара над чистым растворителем через ρо , а над раствором через ρ. Тогда относительное понижение давления пара над раствором будет представлять дробь:
(ρо – Δ) / ρо.
Математическим выражением закона Рауля является уравнение:
(ρо – ρ) / ρо = χВ,
где χВ - молярная доля растворëнного вещества.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим. 6-5) Понижение давления пара растворителя над раствором пропорционально мольной доле растворенного вещества. Суть явления с физической точки зрения - уменьшение поверхности испарения. С химической точки зрения - уменьшение количества молекул растворителя за счет сольватации.
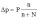 -
I закон Рауля
-
I закон Рауля
Повышение Т кипения раствора - понижение давления пара растворителя приводит к необходимости увеличения температуры, при которой pпара=pатм (кипение).
Понижение температуры замерзания раствора (pпара над ж.=pпара над тв.).
Повышение Т кипения и понижение Т замерзания раствора не зависят от природы растворенного вещества, а зависят только от количества растворенных частиц (моляльной концентрации) -II закон Рауля.
DТкип. = Еm, Е - эбулиоскопическая константа
DТзам. = Кm, К - криоскопическая константа
Е и К - характеристики растворителя.
6-6) Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
Степень диссоциации. Константа диссоциации.
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации и составу молекулы электролита, например:
c H2SO4 = |
2c c 2H+ + SO42- |
Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.
Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N): α = n / N
и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
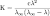
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём.
Изотонический коэффициент (обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе.
Изотонический же коэффициент равен отношению:
i=1+альфа (n-1)
6-7) Растворы сильных электролитов. Сильные электролиты в растворах практически полностью диссоциированы. Концентрация ионов в растворах сильных электролитов настолько велика, что начинают проявляться силы межионного взаимодействия. Свойства электролита, зависящие от числа ионов, проявляются при этом слабее, чем можно было ожидать при диссоциации электролита на невзаимодействующие ионы. Это проявляется в том, что кажущиеся концентрации ионов оказываются меньше их реальных концентраций. Такие “кажущиеся” концентрации называют активностями и обозначают a. Активность иона связана с его концентрацией соотношением:
a = fC
где f – коэффициент активности иона (безразмерный). Коэффициенты активности ионов зависят от состава и концентрации раствора, от заряда и природы иона и ряда других условий. В разбавленных растворах можно приближенно считать, что коэффициент активности иона зависит только от его заряда и ионной силы раствора I, которая может быть определена по формуле:
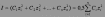
где Сi - концентрация i-го иона, zi - его заряд. Коэффициент активности иона в разбавленном растворе можно приближенно вычислить по формуле:
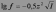
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
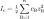 ,
,
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
6-8)Электролитическая диссоциация воды. Водородный показатель рН и PoH.
Вода представляет собой слабый амфотерный электролит:
Н2О
![]() Н+
+ ОН-
Н+
+ ОН-
или, более точно:
2Н2О Н3О+ + ОН-
Константа диссоциации воды при 25оС равна:
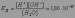
Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л. Тогда
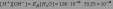
Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW:
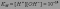
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13.
В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой:
[H+] = [OH-] = 10-7 моль/л
Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными.
Если к чистой воде прибавить кислоту, концентрация ионов водорода повысится и станет больше, чем 10-7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10-14. Концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды.
На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями.
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
рН = - lg[H+]
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
рОН = - lg[OH-]
Легко показать, прологарифмировав ионное произведение воды, что
рН + рОН = 14
Если рН среды равен 7 - среда нейтральная, если меньше 7 - кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
6-9) Гетерогенные равновесия. Произведение растворимости.
Гетерогенные равновесия в водных растворах характеризуются тем, что перенос частиц происходит через поверхность раздела по крайней мере двух сосуществующих фаз.По своему характеру двухфазные гетерогенные равновесия достаточно многообразны, но здесь будут затронуты лишь некоторые из них:
1. Твердая фаза (осадок) – жидкая фаза (насыщенный раствор вещества, находящегося в осадке). Эта система имеет большое значение, т.к. в химической практике часто приходится одни вещества отделять от других. Осаждение отделяемого вещества с последующим фильтрованием– один из наиболее простых и часто применяемых приемов разделения. Не менее важен и обратный процесс – переведение малорастворимых веществ в раствор.
2. Твердая фаза (ионит) – жидкая фаза (раствор). Ионный обмен широко применяется для очистки воды от примесей (умягчение, обессоливание), а также для разделения веществ, близких по своим химическим свойствам, когда обычные методы химического разделения оказываются неэффективными. Здесь речь идет о ионном обмене на поверхности ионитов (катионитов и анионитов).
3. Жидкая фаза (раствор вещества в растворителе I) – жидкая фаза (раствор вещества в растворителе II). Этот случай реализуется тогда, когда некоторое вещество растворено в двух несмешивающихся друг с другом растворителях, причем в одном из них растворимость вещества больше, чем в другом. Практическое применение этого явления носит название экстракции. Экстракция является одним из наиболее применяемых методов разделения веществ как в промышленности, так и в химическом анализе.
Произведение растворимости — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Константа равновесия такого процесса называется произведением растворимости. В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
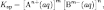
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
6-10)Ионные реакции — реакции между ионами в растворе.
Например, реакцию
AgNO3 + NaCl = NaNO3 + AgCl
можно представить в ионном виде (реакция расписывается на ионы, не расписываются осадки, газы, вода, слабые кислоты и основания, а также малорастворимые и нерастворимые соединения) например AgCl нерастворим в воде и на ионы не расписывается:
Ag+ + NO3− + Na+ + Cl− = AgCl + Na+ + NO3−
Одинаковые ионы сокращаются и получается сокращенное ионное уравнение. Так как взаимодействие произошло между ионами Ag+ и ионами Cl−, то выражение
Ag+ + Cl− = AgCl
и есть ионное уравнение рассматриваемой реакции. Оно проще молекулярного и в то же время отражает сущность происходящей реакции.
