
- •Поверхневі явища та дисперсні системи Методичні вказівки
- •6.051301 «Хімічна технологія»
- •Поверхневі явища та дисперсні системи Методичні вказівки
- •6.051301 «Хімічна технологія»
- •Лабораторна робота № 1 «адсорбція»
- •Стислі теоретичні відомості
- •Робота 1.1. Адсорбція органічної кислоти вугіллям з водного розчину Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 2 «поверхневий натяг. Адсорбція на рідкій поверхні»
- •Стислі теоретичні відомості
- •Методи визначення поверхневого натягу
- •Метод підрахунку крапель
- •Метод максимального тиску газового пухирця (метод Ребіндера)
- •Робота 2.1. Адсорбція на поверхні рідини
- •Хід виконання роботи
- •Робота 2.2. Визначення питомої поверхні адсорбента
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 3 «теплота змочування»
- •Стислі теоретичні відомості
- •Робота 3.1. Визначення природи поверхні гідрофільних та гідрофобних речовин калориметричним методом
- •Питання до лабораторної роботи
- •Лабораторна робота № 4 «седиментація»
- •Стислі теоретичні відомості
- •Робота 4.1. Седиментаційний аналіз суспензії
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 5 «в’язкість»
- •Стислі теоретичні відомості
- •Робота 5.1. Дослідження в’язкості структурованих розчинів
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 6 «одержання та коагуляцiя золів»
- •Стислі теоретичні відомості
- •Робота 6.1. Приготування золів Хід виконання роботи
- •1. Фiзична конденсацiя (замiна розчинника)
- •2. Хiмiчна конденсацiя
- •2.1. Метод окисно-вiдновних реакцiй
- •2.2. Метод реакцiй обмiну
- •2.3. Реакцiя гiдролiзу
- •3. Отримання золю гiдроксиду залiза (III) пептизацiєю
- •3.1. Адсорбцiйна пептизацiя
- •3.2. Диссолюцiйна пептизація
- •4. Одержання емульсiї
- •Робота 6.2. Визначення знаку заряду частинок золів на підставі правила валентності – значності Хід виконання роботи
- •Робота 6.3. Визначення порогу коагуляцiї золю Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 7 «електрофорез»
- •Стислі теоретичнi вiдомостi
- •Робота 7. 1. Визначення знаку та величини електрокiнетичного потенцiалу методом електрофорезу
- •Питання до лабораторної роботи
- •Перелік рекомендованої літератури
Питання до лабораторної роботи
Що таке поверхневий натяг? Від чого він залежить?
Яке рівняння описує залежність поверхневого натягу розчину ПАР від його концентрації?
Чому для однакового об’єму різних рідин характерна різна кількість крапель, що витікають з капіляра?
Що таке поверхнева активність ПАР та як вона визначається в лабораторній роботі?
Як змінюється поверхнева активність ПАР у гомологічному ряді зі збільшенням вуглецевого ланцюга?
Для чого в лабораторній роботі визначають питому надлишкову адсорбцію Г?
Що таке гранична адсорбція та від чого вона залежить?
Як обчислюють геометричні параметри молекул ПАР у даній лабораторній роботі?
Література: [1] 114 – 136; [2] 72 – 89; [3] 39 – 52; [4] 20 – 27, 33 – 37.
Лабораторна робота № 3 «теплота змочування»
Перед тим, як приступити до лабораторної роботи з вивчення змочування твердих тіл рідинами, необхідно ознайомитися з такими поняттями: змочування, крайовий кут змочування, теплота змочування, коефіцієнт змочування.
Стислі теоретичні відомості
Рідина може або розтікатися по поверхні твердого тіла, або збиратися на поверхні у вигляді крапель різної форми. Кут, який утворює крапля з поверхнею твердого тіла, називається крайовим кутом змочування та являє собою кількісну характеристику змочування (рис. 11). Чим менший крайовий кут, тим краще дана рідина змочує поверхню.

Рис. 11. Крайовий кут змочування
Якщо крайовий кут змочування гострий (θ < 900), то поверхня добре змочується рідиною і називається ліофільною. Якщо крайовий кут тупий (θ > 900), то поверхня погано змочується рідиною і називається ліофобною.
Тверді фази, що добре змочуються водою, називаються гідрофільними, а фази, що погано змочуються, ‑ гідрофобними. Гідрофільними матеріалами є оксиди, карбонати, сульфати, солі кисневмісних кислот, скло, целюлоза; гідрофобними – сірка, графіт, сульфіди металів, більшість полімерних матеріалів.
Для порошкоподібних тіл визначення крайового кута змочування є неможливим, а тому характеристикою їхнього змочування може бути теплота змочування.
Теплотою змочування називається кількість теплоти, яка виділяється при зануренні твердої фази у рідину. Для порошкоподібних речовин теплоту змочування відносять до одиниці маси (1 г або 1 кг) матеріалу і називають інтегральною теплотою змочування.
Теплота змочування дорівнює зменшенню поверхневої енергії твердого тіла при перенесенні його з повітря або з вакууму в рідину. Вона завжди є від’ємною, тобто змочування супроводжується виділенням більшої або меншої кількості теплоти. Для гідрофільних фаз екзотермічність процесу змочування водою більша, ніж при змочуванні вуглеводнями, а для гідрофобних – навпаки.
Характеристикою
міри гідрофільності поверхні матеріалу
є відношення теплот змочування матеріалу
водою Q1
та неполярною рідиною Q2:
![]() ,
яке називається
коефіцієнтом змочування. Для гідрофільних
тіл
> 1, для гідрофобних – < 1.
,
яке називається
коефіцієнтом змочування. Для гідрофільних
тіл
> 1, для гідрофобних – < 1.
Робота 3.1. Визначення природи поверхні гідрофільних та гідрофобних речовин калориметричним методом
Метою роботи є кількісне визначення гідрофільності або гідрофобності порошків шляхом калориметричних вимірювань змочування їхніх поверхонь розчинниками різної природи та обчислення коефіцієнтів змочування .
Визначення проводиться в широкій пробірці, яку розташовано у термосі. Пробірка закриваться пробкою, в якій закріплено термометр Бекмана (точність вимірювання ±0,01 0С) та мішалку. Прилад для визначення теплових ефектів процесів називається калориметром.
З метою визначення теплоємності калориметра мірним циліндром відміряти в калориметричну пробірку 30 см3 дистильованої води та точно (±0,001 г) зважити на аналітичних терезах ~ 1 г KCl.
Перемішуючи воду мішалкою, зробити 6 вимірів температури з інтервалом 30 секунд за умови встановлення рівномірного ходу температури (температура після кожного вимірювання зростає або зменшується на одну й ту ж величину) і записати в табл. 3.1.
Таблиця 3.1. Результати вимірювань температури при змочуванні речовин
Властивості розчинників при 20 оС |
Вода |
Бензол |
||||||||
Питома
теплоємність С,
|
4,184 |
1,711 |
||||||||
Густина , г/см3 |
0,998 |
0,879 |
||||||||
Об’єм
|
30 |
30 |
||||||||
Номер виміру |
Покази термометра Бекмана |
|||||||||
Вода |
Вода |
Вода |
Бензол |
Бензол |
||||||
|
KCl |
Крохмаль |
Вугілля |
Вугілля |
Крохмаль |
|||||
1 |
|
|
|
|
|
|||||
2 |
|
|
|
|
|
|||||
….. |
|
|
|
|
|
|||||
15 |
|
|
|
|
|
|||||
Т |
|
|
|
|
|
|||||
Ск, Дж/К |
|
|
||||||||
Q, Дж |
|
|
|
|
||||||
Всипати наважку KCl та енергійно перемішати, продовжуючи записувати температуру в табл. 3.1 з такими самими інтервалами часу (ще 5–7 вимірів після встановлення рівномірного ходу температури). Покази термометра Бекмана упродовж дослідів записувати в табл. 3.1.
Побудувати графік температурного ходу для точного визначення Т з урахуванням теплообміну з оточуючим середовищем (рис. 12). Стрибок температури Т визначити екстраполяцією прямих АВ та CD на середину головного періоду ВС.
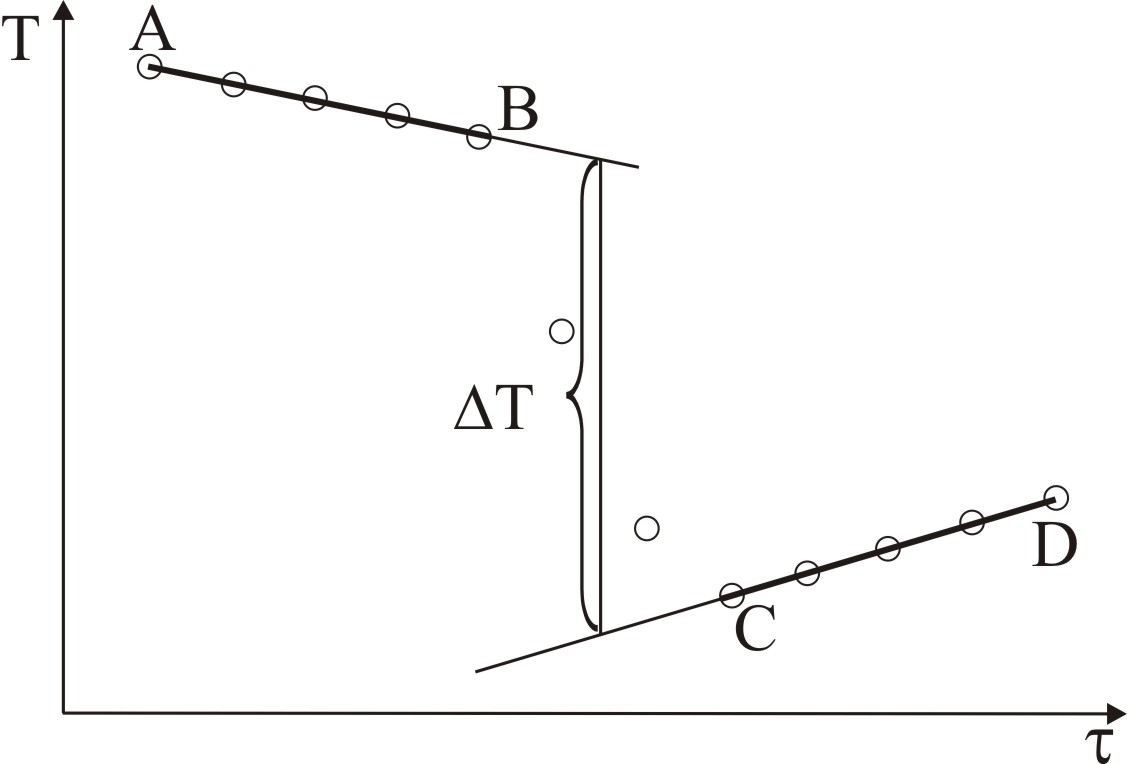
Рис.12. Графік для визначення зміни температури T при розчиненні KCl
На графіку відрізок АВ – попередній період, CD – заключний період, ВС – головний період, тривалість якого визначається крайніми точками В і С, де рівномірний хід температури переривається.
Розраховувати теплоємність калориметра Ск (Дж/К) за формулою:
|
(3.1) |
де а – наважка солі, г; M – молярна маса KCl, г/моль; QKCl –теплота розчинення KCl, яка складає 17500 Дж/моль; – густина води, г/см3; С – питома теплоємність води, Дж/(гК).
Вилити розчин солі та помити пробірку.
На технічних терезах зважити по дві наважки крохмалю та активованого вугілля масою 2 г кожна.
У вимиту калориметричну пробірку мірним циліндром налити 30 см3 дистильованої води. Перемішуючи воду мішалкою, зробити 5 –7 вимірів температури з інтервалом 30 с після встановлення рівномірного ходу температури. Всипати в пробірку крохмаль та, інтенсивно перемішуючи вміст пробірки, продовжувати записувати температуру з такими самими інтервалами часу до встановлення рівномірного температурного ходу, після чого зробити ще 5–7 вимірів. Вилити суспензію та помити пробірку.
Аналогічні операції провести з активованим вугіллям. Вилити суспензію вугілля і води та помити пробірку. Витерти пробірку насухо фільтрувальним папером.
У висушену калориметричну пробірку мірним циліндром налити 30 см3 бензолу. Перемішучи бензол мішалкою, зробити 6 вимірів температури з інтервалом 30 с після встановлення рівномірного ходу температури. Засипати в пробірку активоване вугілля і провести вимірювання, аналогічні попереднім дослідам змочування водою. Вилити суспензію вугілля і бензолу у посуд для зливів (у витяжній шафі) та сполоснути пробірку бензолом.
Аналогічні операції провести для дослідження змочування крохмалю бензолом.
Побудувати графіки зміни температури з часом для визначення T. Розраховані значення записати в табл. 3.1.
Розрахувати теплоти змочування за формулою, Дж:
![]() , (3.2)
, (3.2)
де V – об’єм рідини, см3; – густина рідини, г/см3; C – питома теплоємність рідини, Дж/(г∙К); Ск – теплоємність калориметра, Дж/К; T – зміна температури в ході досліду. При розрахунках теплот змочування у рівняння (3.2) слід підставляти властивості (, C) досліджуваної рідини. Результати вимірювань записати в табл. 3.1.
Розрахувати величини коефіцієнтів змочування крохмалю та активованого вугілля як відношення теплот змочування відповідних матеріалів водою та бензолом:
 і зробити висновок про природу речовин.
і зробити висновок про природу речовин.
Звіт
Таблиця 3.1
Графіки T = f() для розчинення KCl у воді та змочування досліджуваних порошків рідинами (всього 5 графіків).
Теплоємність калориметра Ск = .... ... Дж/К.
Значення коефіцієнтів змочування крохмалю = ..............; вугілля = ............
Висновок.
