
- •Часть II
- •1. Введение
- •1.1. Многообразие углеводородов
- •1.2. Классификация углеводородов
- •2.1. Гомологический ряд алканов
- •2.2. Строение алканов
- •2.3. Изомерия алканов
- •2.3.1. Структурная изомерия алканов
- •2.3.2. Поворотная изомерия алканов
- •2.3.3. Зеркальная (оптическая) изомерия
- •2.4. Номенклатура
- •2.4.1. Радикалы в ряду алканов
- •2.4.2. Правила построения названий алканов по систематической международной номенклатуре июпак
- •2.4.3. Назовем соединение по номенклатуре июпак
- •2.5. Химические свойства алканов
- •2.5.1. Крекинг алканов
- •2.5.2. Изомеризация алканов
- •2.5.3. Дегидрирование алканов
- •2.5.4. Реакции окисления алканов
- •2.5.5. Реакции замещения
- •2.6. Галогеналканы
- •2.7. Получение алканов
- •2.8. Применение алканов
- •3.1. Изомерия циклоалканов
- •3.2. Свойства циклоалканов
- •3.3. Получение циклоалканов
- •I. Br2, h; II. Br2 (вода); III. HCl; IV. KMnO4 (водн. Р-р).
- •6. Какие соединения образуются при действии металлического натрия на следующие вещества:
- •4. Алкены
- •Vrml-модель (2 камеры, 109300 байт).
- •Vrml-модель (37448 байт)
- •4.2. Номенклатура алкенов
- •2 Атома с этан этен; 3 атома с пропан пропен и т.Д.
- •4.3. Изомерия алкенов
- •4.3.1. Структурная изомерия алкенов
- •4.3.2. Пространственная изомерия алкенов
- •Vrml-модель
- •4.4. Свойства алкенов
- •4.4.1 Реакции присоединения к алкенам
- •4.4.1.1. Гидрирование (присоединение водорода)
- •4.4.1.2. Галогенирование (присоединение галогенов)
- •4.4.1.3. Гидрогалогенирование (присоединение галогеноводородов)
- •4.4.1.5. Полимеризация алкенов
- •4.4.2. Реакции окисления алкенов
- •4.4.3. Изомеризация алкенов
- •4.5. Получение алкенов
- •4.6. Применение алкенов
- •4.7. Контрольные вопросы
- •1. Какие модели соответствуют молекулам алкенов?
- •Тройная связь в ацетилене
- •6.2. Номенклатура алкинов
- •6.3. Изомерия алкинов
- •6.4. Свойства алкинов
- •6.4.2. Образование солей
- •6.4.3. Окисление алкинов
- •6.5. Получение алкинов
- •7.1. Строение бензола
- •Cтроение бензола
- •7.2. Гомологи бензола. Номенклатура и изомерия
- •7.3. Свойства аренов
- •7.3.1. Реакции замещения в бензольном кольце
- •1. Галогенирование
- •2. Нитрование
- •7.3.2. Замещение в алкилбензолах
- •7.3.3. Реакции присоединения к аренам
- •7.3.4. Реакции окисления аренов
- •7.4. Получение ароматических углеводородов
- •7.5. Применение ароматических углеводородов
- •9. Заключение. Генетическая связь между углеводородами
- •4.5. Получение алкенов
4.4.1 Реакции присоединения к алкенам
Алкены вступают в разнообразные реакции присоединения.
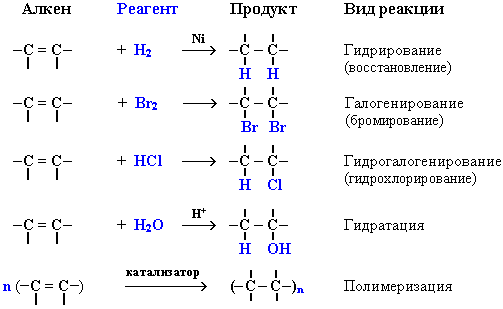
4.4.1.1. Гидрирование (присоединение водорода)
Алкены взаимодействуют с водородом при нагревании в присутствии металлов Pt, Pd или Ni:

Присоединение водорода к атомам углерода в алкенах приводит к понижению степени их окисления:
![]()
Поэтому гидрирование алкенов относят к реакциям восстановления. Эта реакция используется в промышленности для получения высокооктанового топлива.
4.4.1.2. Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи:
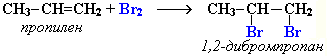
Еще легче происходит присоединение хлора:
![]()
Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
При нагревании до 500°С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
![]()
Электрофильное присоединение – механизм реакции взаимодействия электрофильных реагентов с двойной связью.
Электрофильные ("любящие электроны") реагенты, или короче, электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне (H+, CH3+, Br+, Cl+, NO2+, AlCl3 и т.п.).
Например, при пропускании этилена через водный раствор брома образование электрофильной частицы Br+ происходит следующим образом. В водном растворе молекула Br2 диспропорционирует по схеме:
![]()
Диссоциация сильной бромоводородной кислоты HBr приводит к образованию большого количества протонов H+, которые взаимодействуют с неподеленными электронными парами атомов кислорода слабой бромноватистой кислоты HOBr:
![]()
Образовавшийся катион [Н2ОBr]+ распадается с выделением воды и электрофильной частицы Br+ :
![]()
В неводной среде гетеролитический разрыв связи Br-Br происходит вследствие ее поляризации под влиянием области повышенной электронной плотности у двойной связи в молекуле алкена (-электронного облака).
![]()
Способность алкенов вступать в реакцию с электрофильными реагентами обусловлена повышенной электронной плотностью в области двойной связи (облако -электронов над и под плоскостью молекулы):
-МО (по результатам расчета) (схематическое изображение)
Электрофильное присоединение протекает в несколько элементарных стадий.
I стадия: образование -комплекса. -Электронное облако двойной связи С=С взаимодействует с электрофилом (например, Br+):
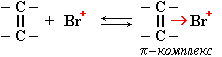
II стадия (лимитирующая): образование карбокатиона. Электрофил (Br+) присоединяется к одному из атомов углерода за счет электронной пары -связи. На втором углеродном атоме, лишенном связывающих -электронов, появляется положительный заряд:

III стадия: взаимодействие карбокатиона с анионом Br-, образовавшемся при диссоциации HBr (или Вr2), которое приводит к продукту реакции:
![]()
Изменение энергии на различных стадиях реакции показано на рис.4.4.1.2, (2921 байт).
 Рис.
4.4.1.2.
Рис.
4.4.1.2.
