
- •Часть II
- •1. Введение
- •1.1. Многообразие углеводородов
- •1.2. Классификация углеводородов
- •2.1. Гомологический ряд алканов
- •2.2. Строение алканов
- •2.3. Изомерия алканов
- •2.3.1. Структурная изомерия алканов
- •2.3.2. Поворотная изомерия алканов
- •2.3.3. Зеркальная (оптическая) изомерия
- •2.4. Номенклатура
- •2.4.1. Радикалы в ряду алканов
- •2.4.2. Правила построения названий алканов по систематической международной номенклатуре июпак
- •2.4.3. Назовем соединение по номенклатуре июпак
- •2.5. Химические свойства алканов
- •2.5.1. Крекинг алканов
- •2.5.2. Изомеризация алканов
- •2.5.3. Дегидрирование алканов
- •2.5.4. Реакции окисления алканов
- •2.5.5. Реакции замещения
- •2.6. Галогеналканы
- •2.7. Получение алканов
- •2.8. Применение алканов
- •3.1. Изомерия циклоалканов
- •3.2. Свойства циклоалканов
- •3.3. Получение циклоалканов
- •I. Br2, h; II. Br2 (вода); III. HCl; IV. KMnO4 (водн. Р-р).
- •6. Какие соединения образуются при действии металлического натрия на следующие вещества:
- •4. Алкены
- •Vrml-модель (2 камеры, 109300 байт).
- •Vrml-модель (37448 байт)
- •4.2. Номенклатура алкенов
- •2 Атома с этан этен; 3 атома с пропан пропен и т.Д.
- •4.3. Изомерия алкенов
- •4.3.1. Структурная изомерия алкенов
- •4.3.2. Пространственная изомерия алкенов
- •Vrml-модель
- •4.4. Свойства алкенов
- •4.4.1 Реакции присоединения к алкенам
- •4.4.1.1. Гидрирование (присоединение водорода)
- •4.4.1.2. Галогенирование (присоединение галогенов)
- •4.4.1.3. Гидрогалогенирование (присоединение галогеноводородов)
- •4.4.1.5. Полимеризация алкенов
- •4.4.2. Реакции окисления алкенов
- •4.4.3. Изомеризация алкенов
- •4.5. Получение алкенов
- •4.6. Применение алкенов
- •4.7. Контрольные вопросы
- •1. Какие модели соответствуют молекулам алкенов?
- •Тройная связь в ацетилене
- •6.2. Номенклатура алкинов
- •6.3. Изомерия алкинов
- •6.4. Свойства алкинов
- •6.4.2. Образование солей
- •6.4.3. Окисление алкинов
- •6.5. Получение алкинов
- •7.1. Строение бензола
- •Cтроение бензола
- •7.2. Гомологи бензола. Номенклатура и изомерия
- •7.3. Свойства аренов
- •7.3.1. Реакции замещения в бензольном кольце
- •1. Галогенирование
- •2. Нитрование
- •7.3.2. Замещение в алкилбензолах
- •7.3.3. Реакции присоединения к аренам
- •7.3.4. Реакции окисления аренов
- •7.4. Получение ароматических углеводородов
- •7.5. Применение ароматических углеводородов
- •9. Заключение. Генетическая связь между углеводородами
- •4.5. Получение алкенов
Vrml-модель (2 камеры, 109300 байт).
4.1. Строение двойной связи С=С
Двойная связь является сочетанием - и -связей (хотя она изображается двумя одинаковыми черточками, всегда следует учитывать их неравноценность). -Связь возникает при осевом перекрывании sp2-гибридных орбиталей, а -связь – при боковом перекрывании р-орбиталей соседних sp2-гибридизованных атомов углерода (часть I, раздел 4.3.2). Образование связей в молекуле этилена можно изобразить следующей схемой:
С=С -связь (перекрывание 2sp2-2sp2) и -связь (2рz-2рz) С–Н -связь (перекрывание 2sp2-АО углерода и 1s-АО водорода)
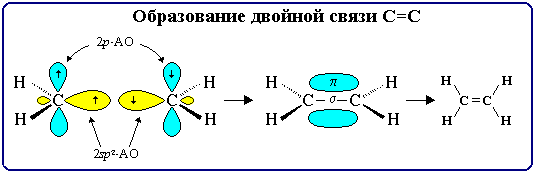
-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула этилена имеет плоское строение:

Модели
молекулы этилена
 аним.
4.1.2
(21005 байт)
аним.
4.1.2
(21005 байт)
Vrml-модель (37448 байт)
По своей природе -связь резко отличается от -связи: -связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей. В молекуле пропилена СН2=СН–СН3 в одной плоскости лежат 6 атомов: два sp2-атома углерода и четыре связанные с ними атома (3 атома Н и атом С группы СН3). Вне этой плоскости находятся атомы водорода в метильной группе СН3, имеющей тетраэдрическое строение, т.к. этот атом углерода sp3-гибридизован.

Аналогичное строение имеют другие алкены.
4.2. Номенклатура алкенов
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен:
2 Атома с этан этен; 3 атома с пропан пропен и т.Д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например:
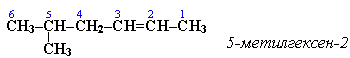
Для простейших алкенов применяются также исторически сложившиеся названия:этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п.
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
![]()
4.3. Изомерия алкенов
Алкенам свойственна изомерия различных типов. Если алкан С4Н10 имеет 2 изомера, то алкену с тем же числом углеродных атомов формулы С4Н8 соответствует уже 5 изомерных соединений (4 алкена и один циклоалкан).
Такое многообразие изомеров объясняется тем, что наряду со структурной изомерией углеродного скелета для алкенов характерны, во-первых, другие разновидности структурной изомерии - изомерия положения кратной связи и межклассовая изомерия.
Во-вторых, в ряду алкенов проявляется пространственная изомерия, связанная с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение. (часть I, раздел 4.2.3.)
4.3.1. Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):

2. Изомерия положения двойной связи (начиная с С4Н8):
![]()
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:

