
- •2)Положения атомно-молекулярного учения. Основные стехиометрические законы химии.
- •4)Закономерности распределения электронов по уровням и подуровням, электронные формулы и схемы элементов. Правило Хунда.
- •5)Периодичность проявления свойств элементов в связи с динамикой изменений атомных радиусов, отражённая в периодической системе д.И. Менделеева.
- •6)Закономерности проявления атомами валентности и степени окисления в зависимости от положения элементов в периодической системе.
- •7)Закономерности изменения электроотрицательности элементов периодической системы и проявления ими метеличности и неметаличности
- •8)Условия образования ковалентной связи. Характеристика её свойств – насыщенности, кратности, полярности, направленности.
- •9)Координационная связь как особый вид кс. Пример.
- •10)Ионная связь: свойства, сходство и отличия от ковалентной. Примеры.
- •11) Сущность водородной связи. Межмолекулярные взаимодействия. Примеры.
- •12)Понятие о скорости хим. Р-ции. В гомогенных и гетерогенных системах; единицах её измерения.
- •13)Закон действия масс; роль концентрации взаимодействующих веществ в гомо- и гетерогенных системах.
- •15)Катализаторы и катализ; сущность биологического катализа и отличие его от химического.
- •16)Химическое равновесие и влияние на него концентраций исходных веществ и продуктов реакции. Константа равновесия.
- •17)Принцип Ле Шателье. Возможности и условия смещения химического равновесия в реакции.
- •19)Классификация растворов. Коллигативные свойства р-ов.
- •22)Константа диссоциации слабого электролита. Ионное произведение воды. Водородный показатель.
- •23)Понятие о гидролизе солей. Влияние на характер гидролиза соли силы образующих её кислот и оснований.
6)Закономерности проявления атомами валентности и степени окисления в зависимости от положения элементов в периодической системе.
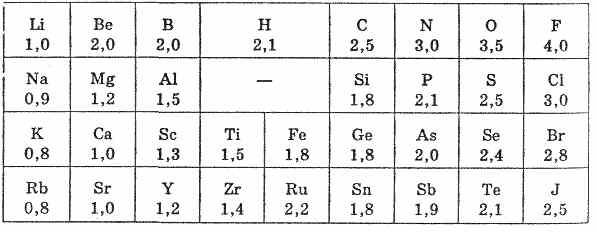
Валентность - это способность атома соединяться с другими атомами. С точки зрения теории строения атомов валентность определяется числом химических связей (или числом общих электронных пар), которыми данный атом соединен с другими.
Высшая валентность элемента численно равна номеру группы, в которой расположен данный элемент по таблице Д.И. Менделеева.
Степень
окисления -
это условный заряд атома в молекуле,
если считать, что все молекулы состоят
из ионов. Степень окисления рассчитывается
алгебраически, учитывая, что сумма
положительных и отрицательных зарядов
в молекуле равна нулю.
![]()
7)Закономерности изменения электроотрицательности элементов периодической системы и проявления ими метеличности и неметаличности
Электроотрицательностью (ЭО) атома называется способность атома в молекуле (соединении) притягивать электроны, связывающие его с другими атомами. Понятие электроотрицательности ввел Л. Полинг (США, 1932 г.). Количественная характеристика электроотрицательности атома весьма условна и не может быть выражена в единицах каких-либо физических величин, поэтому для количественного определения ЭО предложено несколько шкал. Наибольшее признание и распространение получила шкала относительных ЭО, разработанная Л. Полингом.
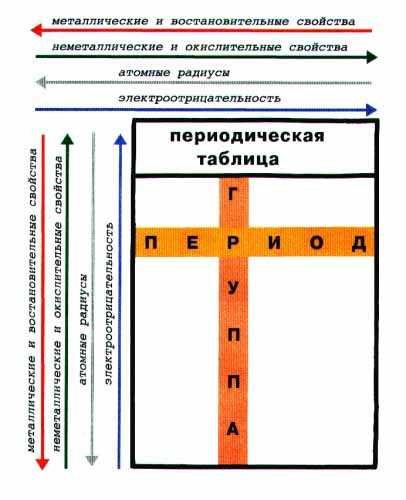
 Закономерности,
связанные с металлическими и
неметаллическими свойствами элементов.
Закономерности,
связанные с металлическими и
неметаллическими свойствами элементов.
1. При перемещении СПРАВА НАЛЕВО вдоль периода МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении - возрастают неметаллические.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
8)Условия образования ковалентной связи. Характеристика её свойств – насыщенности, кратности, полярности, направленности.
Механизмы образования ковалентных связей
Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно-акцепторный, дативный.
При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими.
По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов.
Атомы, внешняя электронная оболочка которых состоит только из s- и р-орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. Примером проявления дативного механизма при образования связи служит взаимодействие двух атомов хлора. Два атома хлора в молекуле Cl2 образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны.
Особенности КС:
1. Прочность КС — это свойства характер длинной связи (межъядерное пространство) и энергии энергией связи.
2. Полярность КС. В молекулах, содержащих ядра атомов одного и того же элемента, одна или несколько пар электронов в равной мере принадлежат обоим атомам, каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью.
Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью.
3. Насыщаемость КС — это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии.
4. Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол.
5. Гибридизация КС — при гибридизации происходит смещение атомных орбиталей, т.е. происходит выравнивание по энергии и по форме. Существует sp, sp2, sp3 —гибридизация. sp — форма молекулы линейная (угол 1800), sp2 — форма молекулы плоская треугольная (угол 1200), sp3 - форма тетраэдрическая (угол 109028).
6. Кратность КС или делоколизация связи — Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия.
