- •4. Формула мгновенной скорости.
- •6. Формула ускорения при криволинейном движении(по окружности)
- •7. Силы инерции
- •8. Силы инерции при криволинейном движении(по окруж)
- •Силовые поля
- •16. Определение консервативных сил
- •17. Доказать что работа консервативных сил на замкнутом пути равна 0
- •18. Физические поля(определение однородного поля)
- •19. Центральное поле силы(?!?)
- •22. Связь между потенциальной энергией и силой(формула с градиентом).
- •23. Полная механическая энергия
- •Полная механическая энергия: - характеризует движение и взаимодействие тел; и - является функцией скоростей и взаимного расположения тел.
- •24. Закон сохранения механической энергии для м.Т закон сохранения механической энергии
- •28. Момент инерции для тонкого однородного стержня(формула)
- •30. Кинетическая энергия вращения
- •31. Момент импульса.
- •32. Закон сохранения момента импульса. Закон сохранения момента импульса
- •33. Принцип относительности Галилея
- •34. Преобразование скоростей и ускорений .
- •35. Принцип относительности Эйнштейна
- •36.Принцип постоянства скорости света.
- •38.Следствия из преобразований Лоренца(время, длина)
- •39. Релятивистский закон сложения скоростей
- •42.Связь энергии с импульсом
- •43. Определение колебаний, их виды и характеристики
- •44. Математический,пружинный и физический маятники
- •45. Энергия гармонических колебаний
- •47. Вынужденные колебания
- •49. Упругие волны
- •51. Уравнение бегущей волны
- •52 Основные положения мкт: 3 основных положения молекулярно - кинетической теории:
- •1. Виды степеней свободы и число степеней свободы в идеальном газе
- •Формула
- •7.Явления переноса (диффузия, теплопроводность, вязкость)
- •8.Определение термодинамики и её параметров
- •9. Работа газов и изменение объемов
- •15. Работа при адиабатном процессе
- •16.Политропные процессы
- •18. Тепловая и холодильная машина
- •20. Цикл Карно и кпд идеального газа
- •21. Энтропия и её свойства
- •22 . Энтропия идеального газа
- •23 Статистический смысл 2-го начала термодинамики
- •24 Реальные газы
- •27. Экспериментальные изотермы реального газа
27. Экспериментальные изотермы реального газа
Реальные газы отличаются от идеальных тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой сложными силами взаимодействия. При высоких давлениях и достаточно низких температурах реальные газы конденсируются, т. е. переходят в жидкое состояние, чего принципиально не может быть с идеальными газами.
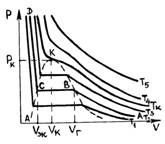
В 1861 году ирландский физик-химик Т. Эндрюс экспериментально исследовал зависимость давления углекислого газа от объема при изотермическом сжатии. На рис. 1 схематично представлены результаты опытов, подобных опытам Т. Эндрюса. Рассмотрим изотерму АВСD.
|
рис. 1 |
На участке АВ уменьшение объема, занятого газом, сопровождается увеличением давления сначала обратно пропорционально объему, затем все медленнее.
В точке В начинается конденсация газа и продолжается при постоянном давлении, называемом давлением насыщенных паров, до точки С. В точке С процесс конденсации газа заканчивается, при дальнейшем уме-ньшении объема осуществляется сжатие жидкости (участок СD), сопровождающееся быстрым ростом давления, свидетельствующее о том, что жидкость слабо сжимаема. При уменьшении давления, действующего на жидкость, вещество пройдет те же состояния в обратном порядке: оно расширится по пути DС до точки кипения, произойдет испарение (путь СВ), а затем получившийся пар расширится до исходного давления (точка А).
На
участке ВС не только давление, но и
температура постоянны. Крайним точкам
отрезка ВС соответствуют однофазные
состояния вещества: точке С (объем
![]() )
– жидкое, а точке В (объем
)
– жидкое, а точке В (объем
![]() )
– газообразное. В промежуточном
двухфазном состоянии с объемом V часть
вещества с количеством молей
)
– газообразное. В промежуточном
двухфазном состоянии с объемом V часть
вещества с количеством молей
![]() находится
в жидком, а часть с количеством молей
находится
в жидком, а часть с количеством молей
![]() –
в газообразном состоянии. Определим
отношение количества молей жидкой и
газообразной фаз в объеме V .
–
в газообразном состоянии. Определим
отношение количества молей жидкой и
газообразной фаз в объеме V .
Объем одного моля жидкой и газообразной фаз вещества соответственно равны:
|
|
(5.1.1) |
Объем V содержит молей жидкой фазы и молей газообразной фазы, поэтому этот объем можно представить в виде суммы объемов жидкой и газообразной фаз следующим образом:
|
|
(5.1.2) |
После простых преобразований из выражения (5.1.2) находим искомое отношение
|
|
(5.1.3) |
Умножая числитель и знаменатель левой части выражения (5.1.3) на молярную массу вещества, получим аналогичное отношение для масс жидкой и газообразной фаз:
|
|
(5.1.4) |
На
рис. 1 представлены изотермы газа при
различных температурах
![]() Из
рисунка видно, что с ростом температуры
горизонтальный участок, соответствующий
двухфазному состоянию вещества,
уменьшается и при некоторой температуре
Из
рисунка видно, что с ростом температуры
горизонтальный участок, соответствующий
двухфазному состоянию вещества,
уменьшается и при некоторой температуре
![]() ,
называемой критической, стягивается в
точку K . Изотерма, соответствующая
температуре
,
называется критической изотермой, то
Фазовый переход
чка K которой является точкой перегиба.
,
называемой критической, стягивается в
точку K . Изотерма, соответствующая
температуре
,
называется критической изотермой, то
Фазовый переход
чка K которой является точкой перегиба.
28. Фазовый переход
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Наиболее часто рассматриваются фазовые переходы при изменении температуры, но при постоянном давлении (как правило равном 1 атмосфере). Именно поэтому часто употребляют термины «точка» (а не линия) фазового перехода, температура плавления и т. д. Разумеется, фазовый переход может происходить и при изменении давления, и при постоянных температуре и давлении, но при изменении концентрации компонентов (например, появление кристалликов соли в растворе, который достиг насыщения).