
- •Растворы
- •4.1. Идеальные и реальные растворы
- •4.2. Давление насыщенного пара компонентов над раствором. Закон Рауля
- •4.3. Диаграммы состояния жидкость - пар для бинарных систем. Разделение растворов путем перегонки. Законы Коновалова
- •4.4. Второй закон Коновалова. Азеотропные смеси
- •4.5. Ограниченная взаимная растворимость жидкостей
- •4.6. Перегонка с водяным паром
- •4.7. Закон распределения третьего компонента между несмешивающимися жидкостями (закон Нернста). Экстракция
- •4.8. Законы растворимости газов в жидкости
- •Идеальная растворимость твердых веществ
- •4.10. Криоскопия
- •4.11. Эбулиоскопия
- •4.12. Осмотическое давление растворов
- •4.13. Биологическое значение осмотического давления
- •4.14. Контрольные вопросы
- •Состав изучаемой системы
4.12. Осмотическое давление растворов
Если раствор отделен от растворителя мембраной, которая проницаема для растворителя, но непроницаема для растворенного вещества, то растворитель переходит через мембрану в раствор, где химический потенциал растворителя меньше. Этот процесс называется осмосом.
Явление осмоса можно наблюдать с помощью осмометра (рис. 4.16).
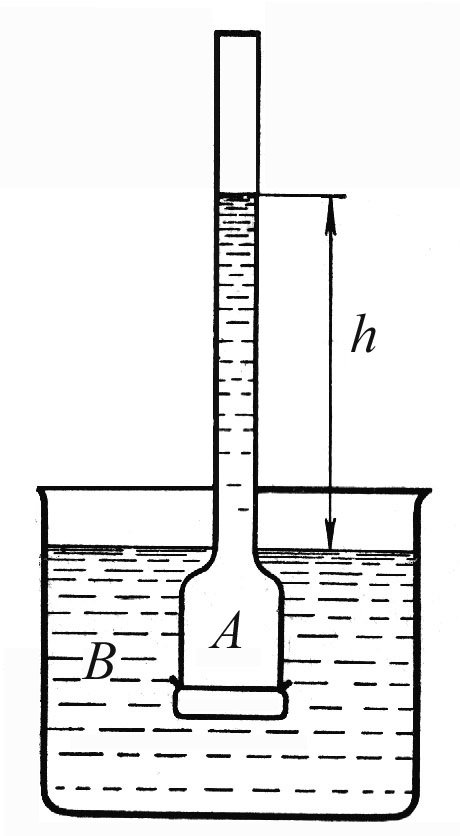
Рис.4.16. Простейший осмометр.
Пусть
в сосуд В
налит чистый растворитель, а в сосуд А
– раствор, разделенные полупроницаемой
мембраной. Раствор и растворитель
содержат общий компонент – растворитель,
который может проходить через мембрану.
Направление перехода определяется
разностью химических потенциалов
растворителя в растворе и в чистом
растворителе. Поскольку растворитель
представляет собой чистый компонент,
то давление пара над ним
![]() ,
так как х1=1.
Раствор – двухкомпонентная система, в
ней х1<1
и
,
так как х1=1.
Раствор – двухкомпонентная система, в
ней х1<1
и
![]() .
Поэтому химический потенциал растворителя
в чистом растворителе
.
Поэтому химический потенциал растворителя
в чистом растворителе
![]() будет более высоким,
чем химический потенциал над раствором
будет более высоким,
чем химический потенциал над раствором
![]() ,
и растворитель
буде самопроизвольно переходить из
сосуда В
в сосуд А
через
полупроницаемую мембрану, поднимаясь
вверх по капиллярной трубке. При этом
химический потенциал растворителя в
растворе будет увеличиваться. Сила,
способствующая переходу растворителя
через мембрану, называется осмотическим
давлением.
Уровень жидкости в капилляре будет
повышаться до тех пор, пока гидростатическое
давление столба жидкости высотой h
не станет равным осмотическому давлению
π. Наступит состояние равновесия,
характеризующееся равенством химических
потенциалов растворителя в растворе и
чистом растворителе. При этом осмотическое
давление является тем дополнительным
давлением, которое необходимо приложить
к раствору, чтобы привести его в равновесие
с чистым растворителем, отделенным от
него полупроницаемой мембраной:
,
и растворитель
буде самопроизвольно переходить из
сосуда В
в сосуд А
через
полупроницаемую мембрану, поднимаясь
вверх по капиллярной трубке. При этом
химический потенциал растворителя в
растворе будет увеличиваться. Сила,
способствующая переходу растворителя
через мембрану, называется осмотическим
давлением.
Уровень жидкости в капилляре будет
повышаться до тех пор, пока гидростатическое
давление столба жидкости высотой h
не станет равным осмотическому давлению
π. Наступит состояние равновесия,
характеризующееся равенством химических
потенциалов растворителя в растворе и
чистом растворителе. При этом осмотическое
давление является тем дополнительным
давлением, которое необходимо приложить
к раствору, чтобы привести его в равновесие
с чистым растворителем, отделенным от
него полупроницаемой мембраной:
![]() .
.
Осмотическое
давление зависит от концентрации
раствора и температуры. Для разбавленных
растворов эта зависимость описывается
уравнением Вант-Гоффа:
![]() .
В зависимости от способа выражения
концентрации и размерности R
осмотическое давление выражается либо
в атмосферах, либо в Па (Н/м2):
.
В зависимости от способа выражения
концентрации и размерности R
осмотическое давление выражается либо
в атмосферах, либо в Па (Н/м2):
С
|
R |
π |
|
8,314
|
Па (Н/м2) |
|
0,082
|
атм. |
4.13. Биологическое значение осмотического давления
Осмос и осмотическое давление имеют большое значение в жизни различных организмов. Особенно наглядно явление осмоса наблюдается в клетках растительных объектов. Начало таким исследованиям положил известный ботаник де Фриз (1834 г.). Каждая растительная клетка покрыта прочной целлюлозной оболочкой (ЦО), к которой плотно прилегает протоплазма (П), обладающая свойствами полупроницаемой мембраны. Протоплазма свободно пропускает воду и не пропускает многие растворенные в воде вещества. Если растительную клетку перенести в концентрированный раствор какого-нибудь вещества (сахар, NaCl), молярная концентрация которого больше, чем раствора внутри клетки (такой раствор называется гипертоническим), то наблюдается высасывание воды из клетки в окружающий раствор (экзоосмос). В результате протоплазма начинает отставать от стенок целлюлозной оболочки и уменьшаться в объеме. Это явление называется плазмолизом. Этот процесс обратим, т.к. при помещении клетки в разбавленный раствор или дистиллированную воду, клетка, благодаря осмотическому всасыванию растворителя, восстанавливается.
Если нормальную растительную клетку поместить в гипотонический раствор, обладающий меньшей концентрацией, чем внутриклеточный раствор, то произойдет всасывание воды в клетку (эндоосмос). Это приводит к растягиванию стенок целлюлозной оболочки, увеличению объема клетки. Состояние осмотического напряжения клетки, обусловленное повышенным осмотическим давлением, называется тургором. Увядание растений связано с уменьшением тургора.
Изотонические растворы не влияют на тургор. Эти растворы еще называются изоосматическими. Они широко применяются в медицине – физиологические растворы.
