
- •Растворы
- •4.1. Идеальные и реальные растворы
- •4.2. Давление насыщенного пара компонентов над раствором. Закон Рауля
- •4.3. Диаграммы состояния жидкость - пар для бинарных систем. Разделение растворов путем перегонки. Законы Коновалова
- •4.4. Второй закон Коновалова. Азеотропные смеси
- •4.5. Ограниченная взаимная растворимость жидкостей
- •4.6. Перегонка с водяным паром
- •4.7. Закон распределения третьего компонента между несмешивающимися жидкостями (закон Нернста). Экстракция
- •4.8. Законы растворимости газов в жидкости
- •Идеальная растворимость твердых веществ
- •4.10. Криоскопия
- •4.11. Эбулиоскопия
- •4.12. Осмотическое давление растворов
- •4.13. Биологическое значение осмотического давления
- •4.14. Контрольные вопросы
- •Состав изучаемой системы
4.4. Второй закон Коновалова. Азеотропные смеси
При значительных отклонениях от закона Рауля на кривых полного давления пара или температуры кипения появляются экстремумы: максимум в случае положительных отклонений и минимум – в случае отрицательных. Экстремумы появляются даже при небольших отклонениях от закона Рауля, если температуры кипения обоих компонентов очень близки. Коновалов установил, что экстремумы на кривых полного давления пара или температуры кипения отвечают такому равновесию, при котором состав обеих фаз одинаков (второй закон Коновалова). Бинарные смеси, отвечающие точкам экстремума, называются азеотропными или нераздельнокипящими.
Такие смеси ведут себя как чистые компоненты, т.к. при перегонке их состав не меняется, но они не являются химическими соединениями, т.к. их состав зависит от внешних условий. Так при изменении давления в системе в разной степени могут измениться температуры кипения компонентов, поэтому экстремум может сначала сместиться в сторону обогащения одним из компонентов, а затем и исчезнуть совсем.
Диаграммы систем, в которых образуется азеотроп (рис.4.7), можно разделить линией ab на две части, каждую из них можно рассматривать как двухкомпонентную систему, которую можно разделить на чистый компонент и азеотроп. Так, из раствора состава х1 в чистом виде можно выделить компонент А, а из раствора состава х2 – компонент В. В обоих случаях чистый компонент отгоняется, а азеотроп остается в колбе. При перегонке растворов с составами х3 и х4 отгоняется азеотроп, а в колбе остается либо А (состав х3), либо В (состав х4).
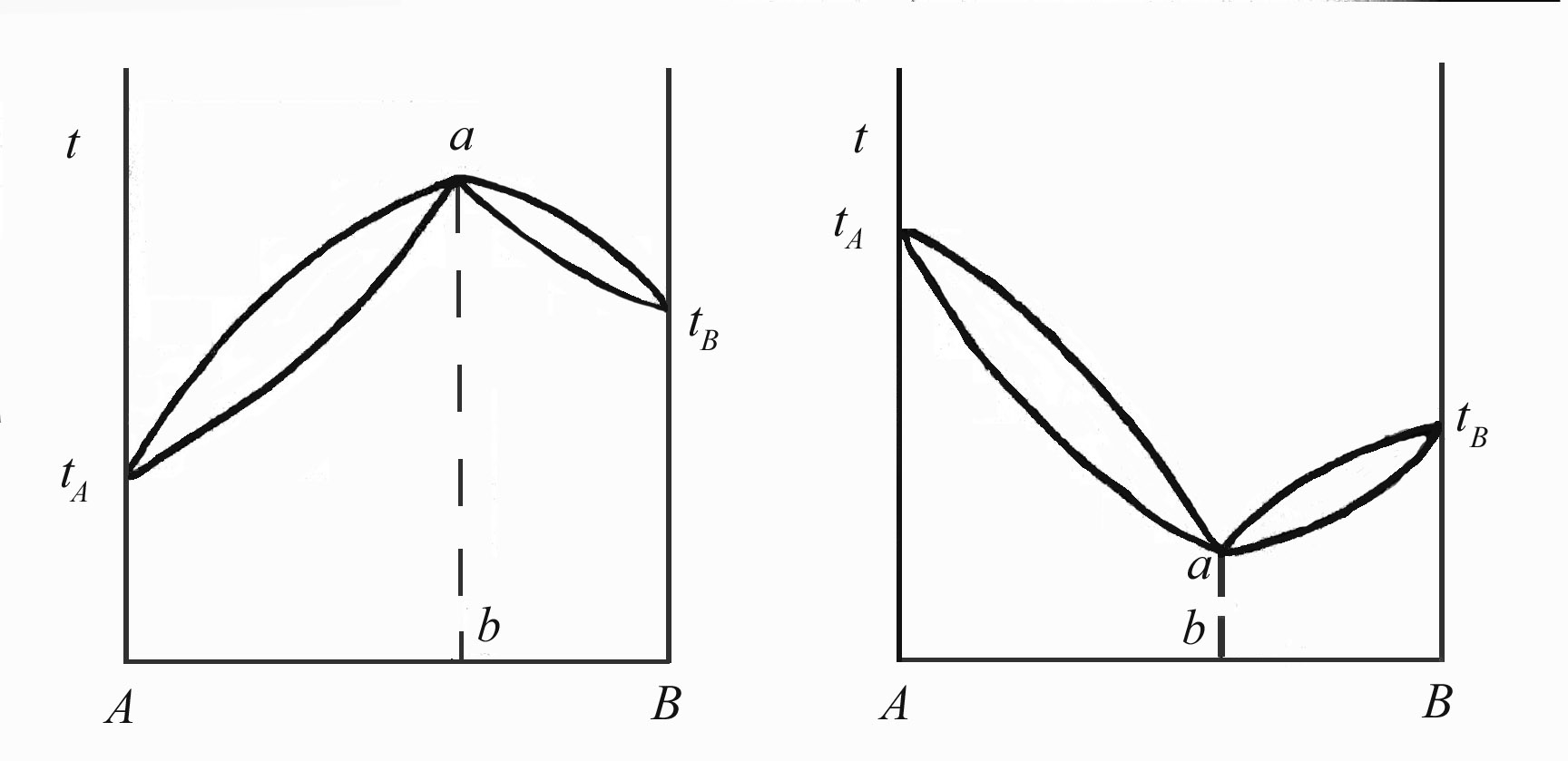
Рис.4.7. Диаграммы температуры кипения – состав бинарных систем, образующих азеотропные смеси.
Для разделения азеотропов используют несколько методов.
Различные химические методы связывания одного из компонентов.
Для улучшения разделения компонентов изменяют давление. Например, азеотропная смесь спирта и воды имеет максимальную температуру кипения, которая при давлении 760 мм рт. ст. соответствует содержанию в ней 95,6% спирта. Если же понизить давление до 100 мм рт.ст., то азеотроп будет содержать 99,6% спирта.
Азеотроп можно разделить, добавляя к раствору третий компонент, который с одним из компонентов смешивается в любых соотношениях, а с другим не смешивается вообще. Так, если в тот же азеотропный раствор спирта с водой прибавить бензол, то образуется двухслойная система, в которой один слой представляет собой бензольно-спиртовой раствор, а другой слой – водный. После разделения этих слоев с помощью делительной воронки, бензольно-спиртовой раствор разделяем на два чистых компонента путем фракционной перегонки.
4.5. Ограниченная взаимная растворимость жидкостей
При очень больших отклонениях от закона Руля, когда они превосходят некоторую критическую величину, наблюдается расслоение раствора на две жидкости, одна из которых представляет раствор вещества В в А, а вторая – А в В. (Взаимная растворимость А и В зависит от температуры.)
Расслоение жидкостей при положительных отклонениях от закона Рауля обусловлено тем, что при образовании раствора частицы одного вещества стремятся равномерно распределиться между частицами другого вещества. Энтропия системы возрастает. Однако равномерному распределению частиц препятствует то, что силы взаимодействия между разнородными молекулами меньше, чем между однородными ( ).
При изменении температуры соотношение между этими факторами (энтропийным и энтальпийным) меняется. Если преобладает энтропийный фактор, то система будет гомогенной. В противном случае происходит расслоение жидкости на два слоя.
В растворах с отрицательными отклонениями силы взаимодействия между разнородными частицами больше, чем между однородными, что способствует равномерному распределению частиц. В этом же направлении действует и энтропийный фактор. В таких системах расслоения не наблюдается.
Растворимость компонентов зависит от температуры. В случае ограниченно растворимых компонентов существует критическая температура (Ткрит), выше или ниже которой компоненты растворяются неограниченно. Существуют системы, имеющие и верхнюю и нижнюю критические точки.
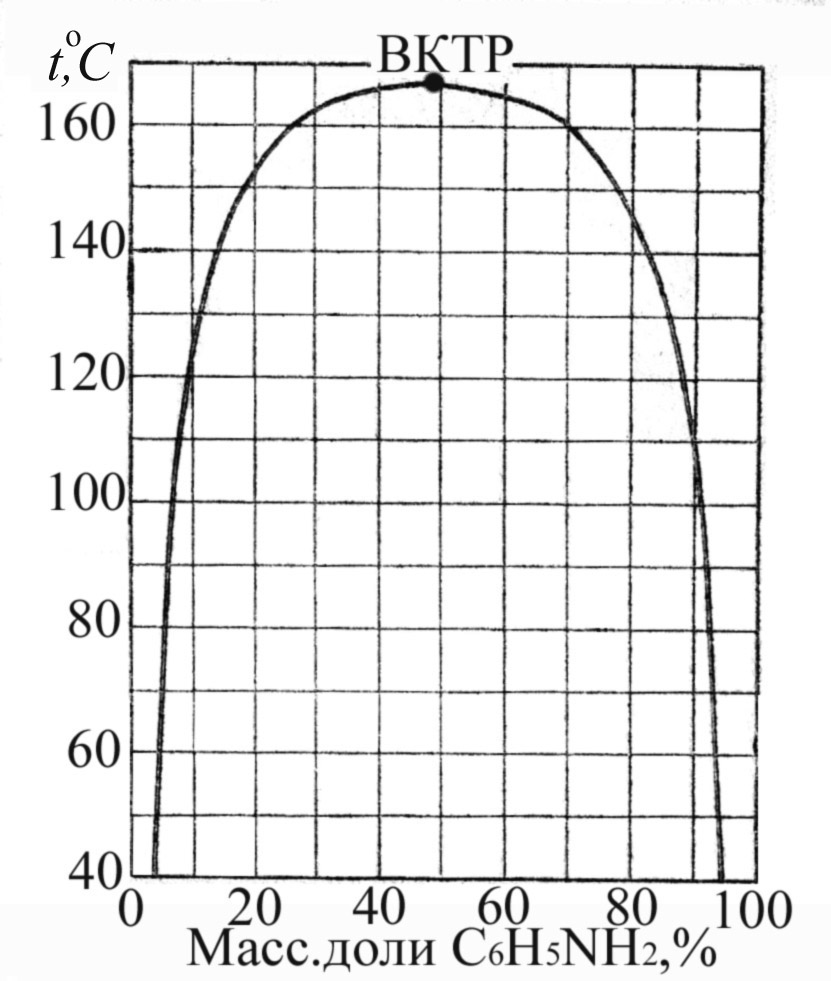
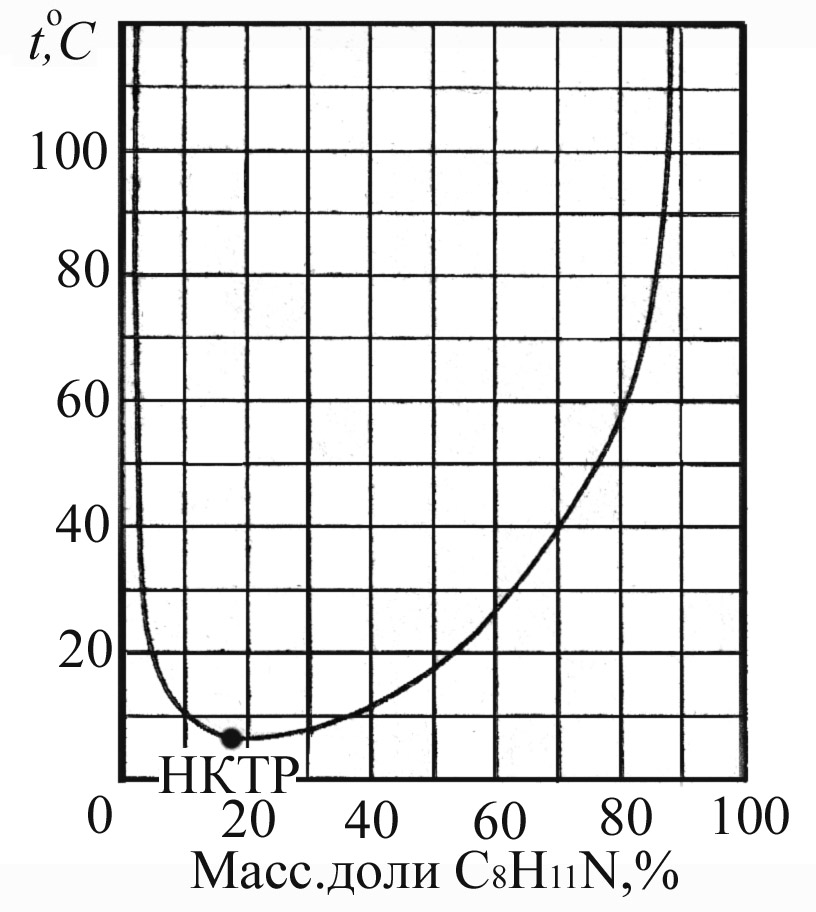
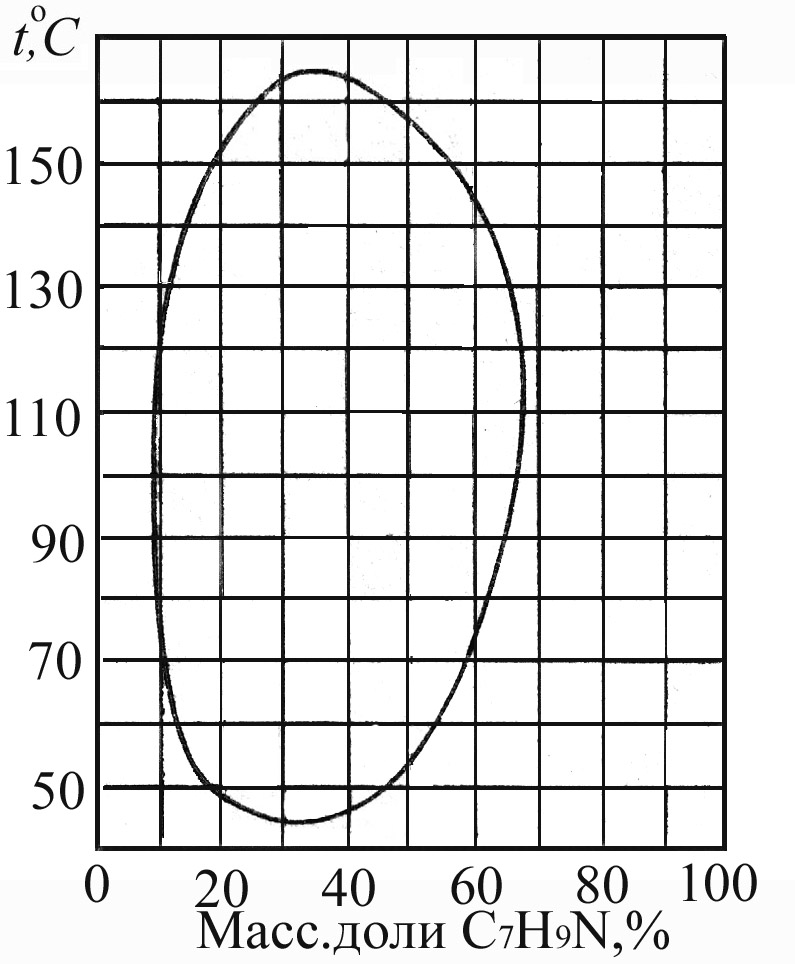
Рис.4.8. Диаграммы состояния для ограниченно растворимых компонентов; а) вода – пиридин (с верхней Ткрит); б) вода – 2, 3, 4-триметилпиридин (с нижней Ткрит); в) вода – 2,6-диметилпиридин (с верхней и нижней Ткрит).
Часть диаграммы, ограниченная кривой, которая называется кривой расслоения или ликвации, отвечает двухфазной системе. Каждой фигуративной точке внутри этой области отвечает равновесие двух растворов, например, пиридина в воде и воды в пиридине (рис.4.8а). Вне кривой система гомогенна.
Критические температуры растворимости определяют по правилу Алексеева. Оно известно как правило прямолинейного диаметра. Согласно ему среднее арифметическое составов двух равновесных (сопряженных) фаз является линейной функцией температуры. Точка пересечения получающейся прямой с кривой расслоения является критической температурой расслоения (рис.4.8в).
