
- •Растворы
- •4.1. Идеальные и реальные растворы
- •4.2. Давление насыщенного пара компонентов над раствором. Закон Рауля
- •4.3. Диаграммы состояния жидкость - пар для бинарных систем. Разделение растворов путем перегонки. Законы Коновалова
- •4.4. Второй закон Коновалова. Азеотропные смеси
- •4.5. Ограниченная взаимная растворимость жидкостей
- •4.6. Перегонка с водяным паром
- •4.7. Закон распределения третьего компонента между несмешивающимися жидкостями (закон Нернста). Экстракция
- •4.8. Законы растворимости газов в жидкости
- •Идеальная растворимость твердых веществ
- •4.10. Криоскопия
- •4.11. Эбулиоскопия
- •4.12. Осмотическое давление растворов
- •4.13. Биологическое значение осмотического давления
- •4.14. Контрольные вопросы
- •Состав изучаемой системы
4.6. Перегонка с водяным паром
Если две жидкости не растворяются друг
в друге, то давления их паров не зависят
от состава раствора, а общее давление
пара смеси равно сумме давлений пара
двух чистых жидкостей:
![]() .
В результате этого смесь кипит при
температуре ниже точки кипения каждой
жидкости. Это свойство несмешивающихся
жидкостей используется при перегонке
высококипящих жидкостей или тех
жидкостей, которые разлагаются при
температуре кипения. В качестве второго
компонента используется водяной пар.
Это значит, что мало летучий компонент
будет перегоняться при температуре
более низкой, чем температура кипения
воды.
.
В результате этого смесь кипит при
температуре ниже точки кипения каждой
жидкости. Это свойство несмешивающихся
жидкостей используется при перегонке
высококипящих жидкостей или тех
жидкостей, которые разлагаются при
температуре кипения. В качестве второго
компонента используется водяной пар.
Это значит, что мало летучий компонент
будет перегоняться при температуре
более низкой, чем температура кипения
воды.

Рис.4.9. График зависимости давления от температуры для несмешивающихся жидкостей (воды и бромбензола).
Другой особенностью перегонки несмешивающихся жидкостей, вытекающей из первой, является то, что отношение парциальных давлений компонентов А и В равно отношению количеств их молей в паре и не зависит от состава раствора до тех пор, пока в нем присутствуют оба компонента.
 ,
,
если В – водяной пар.
Это выражение позволяет по данным приведенного графика рассчитать, какое количество нелетучего компонента перегонится с 1 кг H2O или сколько нужно взять H2O, чтобы перегнать 1 кг нелетучего компонента:
 и
и
![]() .
.
4.7. Закон распределения третьего компонента между несмешивающимися жидкостями (закон Нернста). Экстракция
Если
в систему несмешивающихся жидкостей
внести третий компонент, обладающий
одинаковой молекулярной массой в обоих
растворителях, то он распределится
между двумя растворителями таким
образом, что отношение его концентраций
в двух фазах будет величиной постоянной,
независящей от количества введенного
третьего компонента
![]() ,
вплоть до образования насыщенного
раствора. Эту зависимость иллюстрирует
рисунок 4.10, из которого видно, что
концентрации третьего компонента в
двух растворителях растут пропорционально
друг другу.
,
вплоть до образования насыщенного
раствора. Эту зависимость иллюстрирует
рисунок 4.10, из которого видно, что
концентрации третьего компонента в
двух растворителях растут пропорционально
друг другу.
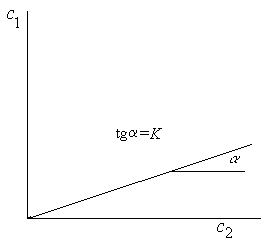
Рис.4.10. Иллюстрация закона распределения Нернста.
Если в одном из растворителей (пусть 1-ом) растворимость будет мала, а в другом велика, то К<<1. Такая система может быть использована с целью экстрагирования (извлечения) третьего компонента. Чем меньше К, тем больше полнота извлечения третьего компонента.
Если молекулярные массы третьего компонента различаются в двух растворителях, например, наблюдается ассоциация (полимеризация) вещества, то закон распределения Нернста выглядит следующим образом
![]() ,
,
где М1 и М2 – молекулярные массы третьего компонента в двух растворителях.
Если
третий компонент диссоциирует, то
постоянным будет отношение
![]() .
.
4.8. Законы растворимости газов в жидкости
Газ не может растворяться в жидкости беспредельно. При некоторой концентрации газа (при определенных p и Т) устанавливается равновесие раствор – газ. Такой раствор называется насыщенным. Концентрация газа (а в общем случае твердого или жидкого вещества) в насыщенном растворе и является растворимостью газа. Растворимость газов в жидкости описывается следующими законами.
Закон Генри. Количество газа, растворенного в единице объема раствора (в г/л или моль/л) увеличивается с ростом парциального давления газа: g=k’p. Это означает, что при T=const отношение растворимости к давлению остается постоянным. Эта закономерность соответствует закону Генри рГ=kГхГ, откуда
 .
.
Идеальная растворимость газов не зависит от природы растворителя.
Положительные отклонения от закона Рауля уменьшают растворимость газа, отрицательные – увеличивают по сравнению с идеальным раствором (рис.4.11)
.
Рис.4.11. Зависимость растворимости газа от характера отклонения раствора
от закона Рауля
Закон Сеченова. В растворах солей растворимость газов заметно уменьшается по сравнению с чистым растворителем (явление высаливания).
И.М.Сеченов
установил закон
![]() ,
где х
и х0
– соответственно мольные доли газа в
растворе соли с концентрацией с
и в чистом растворителе при одинаковых
давлении и температуре. k
– константа, характерная для данной
соли.
,
где х
и х0
– соответственно мольные доли газа в
растворе соли с концентрацией с
и в чистом растворителе при одинаковых
давлении и температуре. k
– константа, характерная для данной
соли.
Графический
анализ уравнения в форме
![]() ,
приведенный на рис.4.12, показывает, что
с ростом концентрации соли в растворе
уменьшается растворимость газа. Этот
закон выполняется в разбавленных
растворах, а приведенная линейная
зависимость используется для определения
константы в уравнении Сеченова.
,
приведенный на рис.4.12, показывает, что
с ростом концентрации соли в растворе
уменьшается растворимость газа. Этот
закон выполняется в разбавленных
растворах, а приведенная линейная
зависимость используется для определения
константы в уравнении Сеченова.

Рис.4.12. Зависимость растворимости газа от концентрации соли в растворе.
Закон Дальтона. Дальтон показал, что индивидуальная растворимость газов, находящихся в смеси, прямо пропорциональна их парциальными давлениям, зависит от их природы, но не зависит от присутствия других газов.
Так
оказывается, что растворимость О2
в воде примерно вдвое больше, чем азота
и, следовательно, растворенный в воде
газ богаче кислородом, чем воздух. При
атмосферном давлении воздуха парциальные
давления азота и кислорода равны
![]() 0,7806
атм. и
0,7806
атм. и
![]() 0,21
атм., т.е. находятся в соотношении 4:1. В
растворенном в воде воздухе содержится
62,9% (об.) азота и 35,3% (об.) кислорода
(соотношение 1,8:1), т.е. в растворе
увеличилось относительное содержание
кислорода.
0,21
атм., т.е. находятся в соотношении 4:1. В
растворенном в воде воздухе содержится
62,9% (об.) азота и 35,3% (об.) кислорода
(соотношение 1,8:1), т.е. в растворе
увеличилось относительное содержание
кислорода.
Растворимость газов при постоянном давлении, как правило, уменьшается с ростом температуры.
Для идеальных растворов эта зависимость описывается уравнением:
![]() .
.
Растворение
газа в жидкости можно представить как
два последовательно протекающих
процесса: 1) конденсация газа и 2) смешение
двух жидкостей. Если образуется идеальный
раствор, то теплота смешения жидкостей
равна нулю, а теплота растворения –
теплоте конденсации (![]() ),
но
),
но
![]() ,
поэтому
,
поэтому
![]() ,
и растворимость газа уменьшается с
ростом температуры.
,
и растворимость газа уменьшается с
ростом температуры.
