
- •Периодическая система элементов д.И.Менделеева.
- •Электронная структура атома и свойства элементов.
- •Периодическая система элементов д.И.Менделеева.
- •Не завершены
- •Электронная структура атома и свойства элементов.
- •Эффективные радиусы атомов, ǻ 1,27 1,39 1,40
- •Орбитальные и эффективные радиусы некоторых атомов и ионов
- •3. Электронные формулы и электронно-структурные схемы атомов. Электроны в атоме распределяются в соответствии со значениями их четырех квантовых чисел и с учетом следующих правил (или принципов):
- •Распределение электронов в атоме, т.Е. Электронную структуру атома, можно выразить в виде электронной формулы или электронно-структурной схемы.
- •2. Основные положения метода валентных связей.
- •Ковалентная связь обладает свойствами насыщаемости, направленности и поляризуемости. Разберем эти свойства.
- •3. Межмолекулярное взаимодействие. Это взаимодействие молекул подразделяется на ориентационное, индукционное и дисперсионное.
- •1. Понятия и определения химической термодинамики.
- •2. Изменение энтальпии в химических реакциях.
- •Изменение энтропии в химических реакциях.
- •Тема 6: Энергетика и направление химических реакций.
- •Энтропия системы. Уравнение Больцмана.
- •3. Энергия Гиббса. Направления химических реакций.
- •Так как g298 реакции 0, то при 298к данная реакция возможна в прямом направлении.
- •Зависимость скорости реакции от концентрации веществ.
- •Зависимость скорости реакции от температуры. Энергия активации.
- •Лекция 8: Химическое равновесие.
- •Смещение химического равновесия. Принцип Ле-Шателье.
- •Смещается вправо (), а при понижении давления влево ().
- •Энергия активации каталитических реакций и сущность действия катализатора.
- •Многокомпонентные системы
- •3. Растворы.
- •Тема 10: Коллигативные свойства разбавленных растворов.
- •Законы Рауля.
- •Осмос и осмотическое давление растворов неэлектролитов. Биологическое значение осмоса и осмотического давления.
- •Понятие о теории сильных электролитов. Активность.
- •Кислотно-основная ионизация.
- •Классификация неорганических соединений с позиции теории электролитической диссоциации.
- •Расчёт концентрации ионов водорода и гидроксильных групп в водном растворе.
- •Классификация неорганических соединений с позиции теории электролитической диссоциации.
- •Расчёт концентрации ионов водорода и гидроксильных групп в водном растворе.
- •Интервал перехода и изменение окраски индикаторов
- •Типы гидролиза солей.
- •Факторы, влияющие на процесс гидролиза.
- •Типы гидролиза солей.
- •Факторы, влияющие на процесс гидролиза
- •Метод полуреакций.
- •Окислительно-восстановительные потенциалы (электродные потенциалы). Определение направления ов-реакций.
- •Лекция 15: Комплексные соединения. Природа химической связи химических соединений.
- •Диссоциация комплексных соединений. Константа образования и нестойкости комплексов.
- •3. Природа химической связи в комплексных соединениях.
- •Биологическая роль и применение комплексных соединений.
- •Теория кристаллического поля.
- •Изомерия комплексных соединений.
Кислотно-основная ионизация.
Характер электролитической ионизации гидроокисей общей формулы ЭОН зависит от сравнительной прочности и полярности связей Э—О и О—Н и может протекать по двум типам:
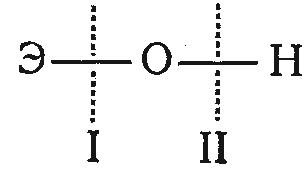
Э ОН Э+ + ОН- (I)
Э OH ЭO- + H+ (II)
Полярность связей, как известно, определяется разностью элект-роотрицательностей компонентов, размерами и эффективным зарядом атомов. Щелочные и щелочноземельные металлы, а также переходныеэлементы в низших степенях окисления образуют ионы относительно большого размера и с малым эффективным зарядом. Поэтому удельный заряд таких ионов невелик и их поляризующие свойства выражены слабо. При этом связь Э—О обладает сравнительно малой прочностью и диссоциация ЭОН идет преимущественно за счет отщепления гидроксила, т. е. по основному типу.
С ростом степени окисления увеличивается удельный заряд Э и преобладает диссоциация по кислотному типу с отщеплением иона водорода, так как связь Э—O упрочняется, а вследствие перераспределения электронной плотности у кислорода связь О—Н ослабевает. Таким образом, диссоциация по кислотному типу протекает, если ео–н << ЕЭ–О, а по основному типу – если ЕО–Н>> ЕЭ–О. При сравнимой прочности связей O—Н и Э—O диссоциация гидроокиси может одновременно протекать и по I и по II типам с отщеплением как гидроксила, так и иона водорода. Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам, называются амфотерными. Амфотерность в той или иной степени является общим свойством гидроокисей.
Количественно ионизация по тому или иному типу характеризуется константой ионизации:
н + + RO- roh R+ + он-
Kосн = [R+][OH-]/[ROH]
Kкисл = [RО-][Н+]/[ROH]
Из данных уравнений следует, что отношение константы ионизации по основному типу Kосн к константе ионизации по кислотному типу Ккисл равно
Kосн/Kкисл = [R+][OH-]/[RO-][H+]
Если отношение Kосн/Kкисл>>1, то ионизация в растворе идет преимущественно по основному типу, т.е. концентрация ионов ОН- во много раз превышает концентрацию гидратированных протонов Н+. Если же Kосн/Kкисл<<1, диссоциация протекает по кислотному типу. При Kосн/Kкисл 1 диссоциация одновременно и в равной мере протекает по обоим типам. Например, для гидроокиси галлия Ga(OH)3 константы ионизации, соответствующие уравнениям
G a(OH)3 Ga3+ + 3OH-
G a(OH)3 3H+ + GaO33-
равны приблизительно 10-12 (т. е. Kосн = Kкисл). Следовательно, гидроокись галлия служит примером идеального амфолита (амфотерного электролита).
Применение принципа Ле-Шателье к кислотно-основному равновесию показывает, что с увеличением концентрации гидроксила возрастает вероятность ионизации по кислотному типу, а увеличение концентрации иона водорода приводит к преимущественной диссоциации по основному типу. Таким образом, в кислой среде амфолит проявляет основной, а в щелочной среде – кислотный характер. Например, гидроокись цинка при взаимодействии с кислотами ведет себя как основание:
Zn(ОН)2 + 2НС1 → ZnCl2 + 2Н2О
а при взаимодействии со щелочами – как кислота (H2ZnO2 или Zn(OH)2):
H2ZnO2 + 2NaOH → Na2ZnO2 + 2Н2О
Рассмотрим основные закономерности изменения характера ионизации гидроокиси в растворе в зависимости от положения элемента в Периодической системе. В ряду элементов III периода от натрия к хлору степень окисления растет, а эффективные ионные радиусы заметно уменьшаются. Ниже приведено изменение ионных радиусов элементов III периода в высшей степени окисления:
Элемент ........ Na Mg Al Si P S Cl
Степень окисления ... +1 +2 +3 +4 +5 +6 +7
Ионный радиус, Å ... 0,98 0,78 0,57 0,39 0,34 0,29 0,26
В этом ряду резко возрастает объемная плотность заряда. Поэтому поляризующее действие ионов элементов, приводящее к перераспределению электронной плотности между связями Э—О и О—Н, возрастает в том же направлении. Гидроокиси крайних членов рассматриваемого ряда обладают чрезвычайно резко выраженными основными (NaOH) и кислотными (НС1O4) свойствами. Гидроокись натрия принадлежит к классу сильных растворимых оснований и является одной из самых сильных щелочей. Хлорная кислота по силе превышает такие кислоты, как НСl, H2SO4, HNO3 и др.
При переходе от натрия к магнию наблюдается некоторое ослабление основных свойств, однако Mg(OH)2 все же представляет собой довольно сильное основание. Гидроокись алюминия А1(ОН)3 уже является амфолитом с некоторым преобладанием основных свойств, а гидроокись кремния Si(OH)4 – амфолит с резко преобладающими кислотными свойствами и образует в растворе кислородсодержащие анионы. Последующие члены ряда обладают ярко выраженной склонностью к образованию в растворе сложных анионов, и соответствующие гидроокиси относятся к кислотам, причем их сила в ряду высших кислот Н2РO4 – H2SO4 – НС1O4 возрастает.
Для переходных металлов, образующих гидроокиси с переменной степенью окисления, характерны те же закономерности в изменении свойств. С возрастанием степени окисления и уменьшением при этом эффективного радиуса ионов ослабевают основные и нарастают кислотные свойства. В качестве примера рассмотрим ряд гидроокисей марганца Мn(ОН)2, Мn(ОН)3, Мn(ОН)4, Н2МnO4, НМnO4, в котором степень окисления марганца меняется в последовательности +2, +3, +4, +6, +7. Первые две гидроокиси – основания, последние две – кислоты, а гидроокись Mn(OH)4 – амфолит с некоторым преобладанием кислотных свойств.
Таким образом, если элемент образует гидроокиси в нескольких степенях окисления, то его гидроокиси в низших степенях окисления обладают более основным (или менее кислотным) характером, а гидроокиси в высших степенях окисления – более кислотным (или менее основным) характером.
Лекция 12: Кислоты, основания и соли по теории электролитической диссоциации.
