
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Вид используемого электромагнитного излучения
- •Глава 20
- •20.1. Основной закон поглощения электромагнитного излучения
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.3.1. Процессы, приводящие к появлению аналитического сигнала
- •20.3.2. Измерение аналитического сигнала
- •20.3.3. Практическое применение
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •20.4.1. Молекулярные спектры поглощения в уф- и видимой области
- •20.4.2. Измерение аналитического сигнала
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Фотометрические реакции
- •Дифференциальная (разностная) фотометрия
- •Производная спектрофотометрия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •Природа вещества
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Глава 22
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •22.3. Хроматографические параметры
- •Хроматографические характеристики, используемые для идентификации веществ (характеристики удерживания)
- •Хроматографические характеристики, используемые для количественного определения веществ
- •22.4. Теории хроматографического разделения
- •Глава 23
- •23.1. Общая характеристика
- •23.2. Устройство газового хроматографа
- •Хроматографическая колонка
- •Детекторы
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Неподвижные и подвижные фазы
- •24.4.2. Эксклюзионная хроматография
- •Глава 25
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •В табл. 25.1 приведена классификация основных электрохимических методов анализа в зависимости от измеряемого параметра.
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.2. Условия измерения аналитического сигнала
- •26.1.3. Индикаторные электроды
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •1) Рабочий электрод;
- •2) Электрод сравнения;
- •3) Вспомогательный электрод
- •26.2.3. Кулонометрическое титрование
- •Глава 27
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •27.3. Некоторые современные разновидности вольтамперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
20.3.3. Практическое применение
ААС используется для количественного определения более 70 элементов, главным образом, металлов.
Зависимость между степенью поглощения электромагнитного излучения и концентрацией поглощающего вещества в ААС такая же, как и в других абсорбционных методах анализа. Оптическая плотность прямо пропорциональна концентрации атомов соответствующего элемента в атомизаторе и, следовательно, в анализируемой пробе
![]()
Коэффициент k является эмпирической величиной. Определение концентрации в ААС проводят методом градуировочного графика или методом добавок.
В Республике Беларусь ААС используется для определения неорганических токсикантов («металлических ядов») в различных биологических объектах при судебно-химическом и химико-токсикологическом исследовании. Пределы обнаружения большинства элементов составляют при использовании пламени 1-100 мкг/л, при электротермической атомизации на несколько порядков меньше. Основные ограничения данного метода анализа связаны с необходимостью наличия большого набора соответствующих ламп, а также необходимостью переведения анализируемого объекта в раствор.
20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
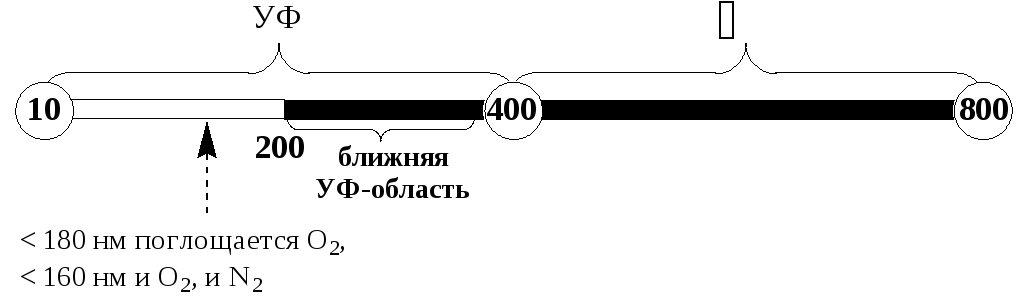
Молекулярную абсорбционную спектроскопию в УФ- и видимой областях спектра называют спектрофотометрией либо фотометрией.
20.4.1. Молекулярные спектры поглощения в уф- и видимой области
Рис.
20.9.
Электронные
переходы в гипотетической молекуле
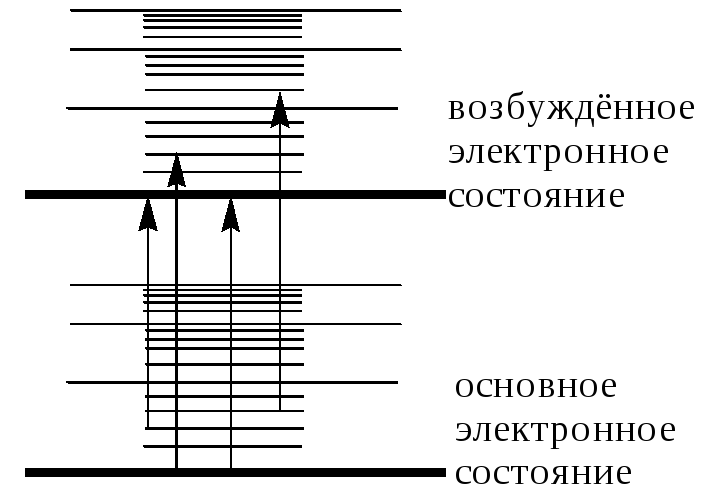
При поглощении электромагнитного излучения УФ- или видимого диапазона молекула переходит из некоторого колебательного и вращательного состояния основного электронного уровня в некоторое колебательное и вращательное состояние следующего электронного уровня (рис. 20.9). Каждый образец вещества содержит огромное число молекул. Даже если все они находятся в основном электронном состоянии, то при этом они могут находиться в разных колебательном и вращательном состояниях. Поэтому вещество будет поглощать не только электромагнитное излучение, соответствующее переходу между самыми низкими колебательными и вращательными состояниями основного и возбуждённого электронного уровней, но и излучение с близкими длинами волн. Кроме того, в многоатомных молекулах возможно много электронных переходов и они могут быть близки по энергии, поэтому в спектре поглощения отдельные полосы поглощения могут сливаться друг с другом. В качестве примера на рис. 20.10 приведен спектр поглощения алкалоида берберина.
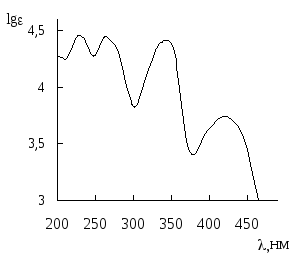
Рис. 20.10. Спектр поглощения берберина бисульфата (водный раствор)
Основными характеристиками полосы поглощения являются её положение и интенсивность (рис. 20.11).
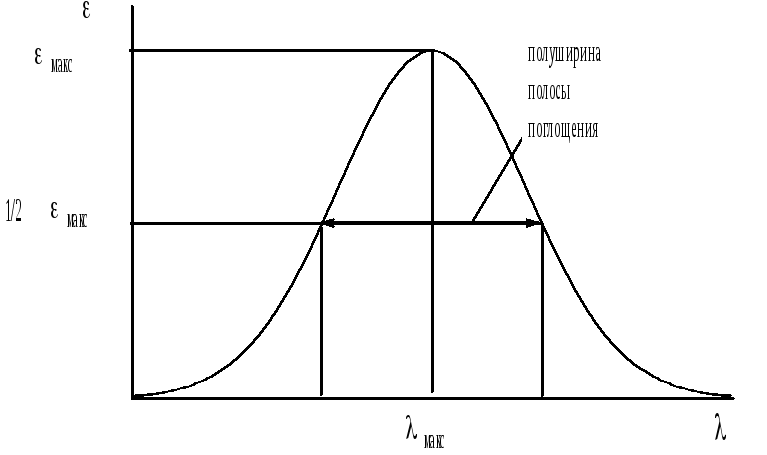
Рис. 20.11. Основные характеристики полосы поглощения
Положение максимума полосы поглощения (макс) соответствует длине волны такого электромагнитного излучения, энергия которого равна энергии необходимой для электронного перехода. Для характеристики ширины полосы поглощения используются величиной полуширины полосы поглощения. Интенсивность поглощения, которую можно охарактеризовать с помощью молярного коэффициента поглощения, зависит от вероятности данного электронного перехода. Поглощение с макс > 104 считается интенсивным (максимально возможное значение составляет примерно 2105), поглощение с макс < 103 считается малоинтенсивным.
Объектами исследования в спектрофотометрии чаще всего являются органические вещества. Зависимость между строением органических соединений и их способностью поглощать электромагнитное излучение УФ- и видимого диапазона обычно изучается в курсе органической химии. Напомним лишь, что в органических соединениях могут происходить 4 типа электронных переходов: *, n *, * и n *. Энергия переходов первых двух типов соответствует энергии УФ-излучения вакуумного диапазона (например, * в молекуле этана - 135 нм, n * в молекуле метанола - 183 нм). Энергия * переходов изолированных -связей соответствует ЭМИ с < 200 нм, например в молекуле этилена - 165 нм. При сопряжении нескольких -связей полосы поглощения смещаются в более длинноволновую область спектра.
Группы, обуславливающие появление полос поглощения в молекулярных спектрах, называются хромофорами. Атомы или группы атомов, которые сами по себе не обуславливают появление полос поглощения, но влияют на характер поглощения хромофоров, называются ауксохромами.
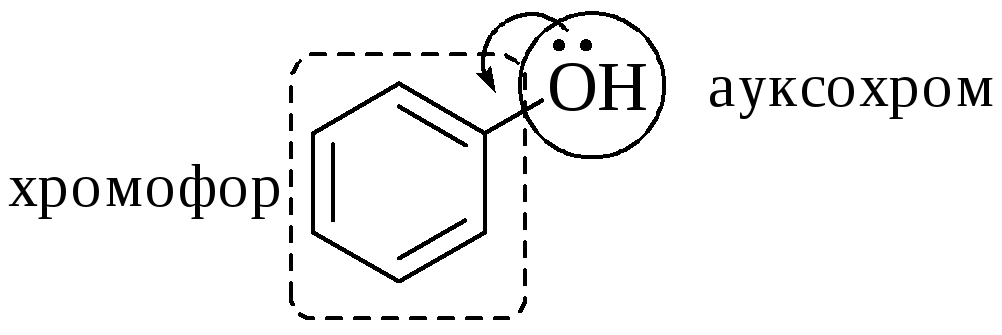
Ауксохромы имеют неподелённые электронные пары, находящиеся в сопряжении с -электронной системой хромофора, и могут сдвигать полосу поглощения хромофора в более длинноволновую область (батохромный сдвиг) или в более коротковолновую область (гипсохромный сдвиг), увеличивать её интенсивность (гиперхромный эффект) или уменьшать её (гипохромный эффект).
