
- •Молекулярная физика.
- •Термодинамический подход к описанию молекулярных явлений.
- •Первое начало термодинамики. Циклические процессы
- •Второе начало термодинамики.
- •Энтропия термодинамической системы. Термодинамические потенциалы.
- •Взаимодействие молекул. Идеальный газ. Основные газовые законы.
- •1. Дискретный спектр энергий :
- •2. Распределение Гиббса.
- •3. Большое каноническое распределение (для ):
- •Теория флуктуаций. Броуновское движение.
- •Реальные газы. Уравнение Ван-дер-Ваальса.
- •Твердые тела. Кристаллы. Симметрия кристаллов.
- •Фазовые переходы первого и второго рода. Условия устойчивости и равновесия.
- •Явления переноса.
- •Кинетическое Уравнение Больцмана. Понятие об н-теореме Больцмана.
- •Плазменное состояние вещества. Уравнение Власова. Понятие о самосогласованном поле.
-
Энтропия термодинамической системы. Термодинамические потенциалы.
Для необратимых круговых процессов выполняется неравенство Клаузиуса, а для обратимых круговых процессов выполняется равенство Клаузиуса: «Приведённое кол-во теплоты, полученное системой при любом квазистатическом круговом процессе, равно нулю».
Энтропия: Энтропия системы есть функция её состояния, определённая с точностью до произвольной постоянной. Разность энтропии в двух равновесных состояниях 2 и 1, по определению, равна приведённому кол-ву теплоты, которое надо сообщить системе, чтобы перевести её из состояния 1 в состояние 2 по любому квазистатическому пути.
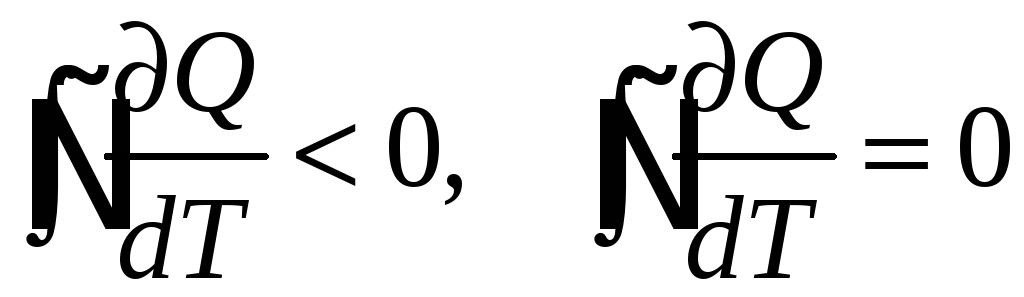
![]() – полный дифференциал
– полный дифференциал
![]()
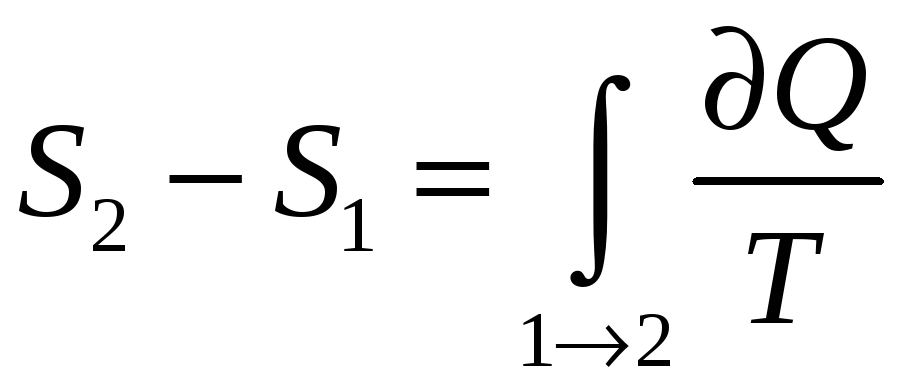 ,
где 1 – необратимый процесс, а 2 –
обратимый
,
где 1 – необратимый процесс, а 2 –
обратимый
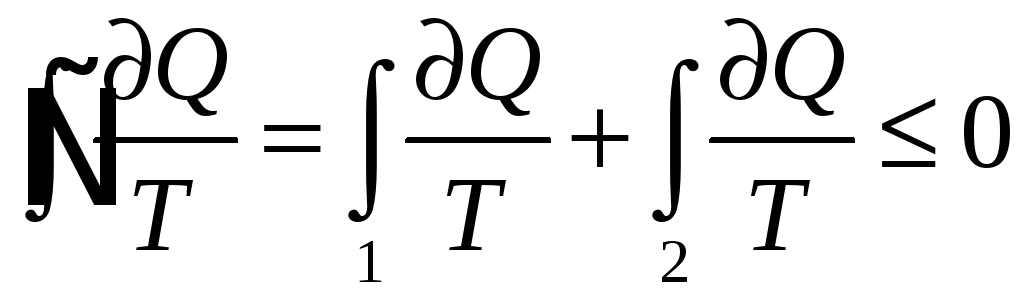
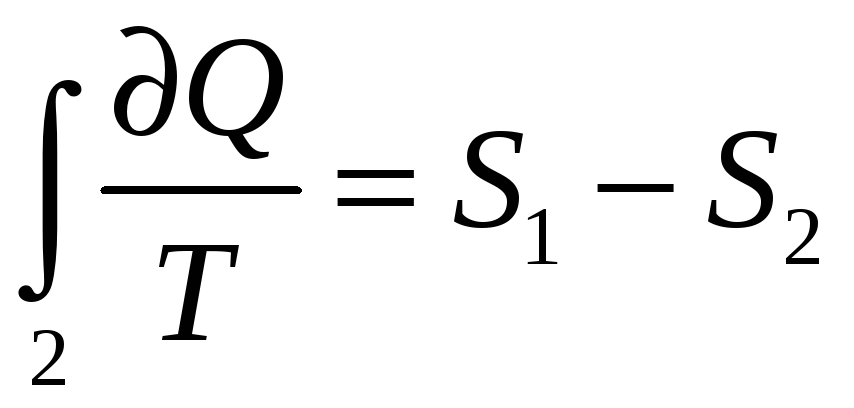 ,
т.к. процесс 2 – квазистатический.
,
т.к. процесс 2 – квазистатический.
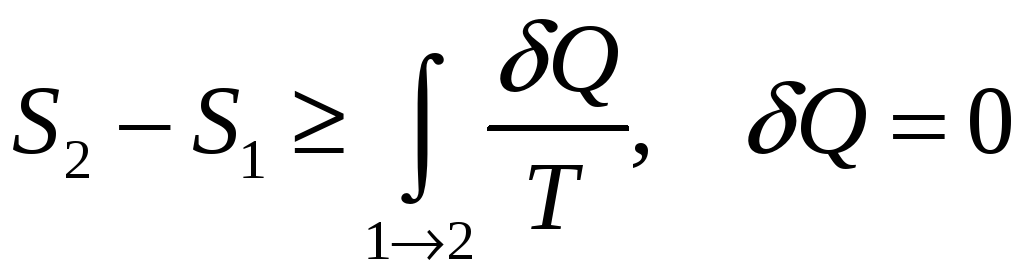 ,
т.к. процесс – адиабатический
,
т.к. процесс – адиабатический
![]()
Закон возрастания энтропии: энтропия адиабатически изолированной системы не может убывать; она либо возрастает, либо остаётся постоянной.
Энтропия – аддитивная функция состояния. При расширении в пустоту энтропия увеличивается. Энтропия максимальна в состоянии равновесия.
Энтропия
![]() определяется логарифмом числа
микросостояний, посредством которых
реализуется рассматриваемое
макросостояние:
определяется логарифмом числа
микросостояний, посредством которых
реализуется рассматриваемое
макросостояние:
![]() – формула
Больцмана.
– формула
Больцмана.
Термодинамические потенциалы.
![]()
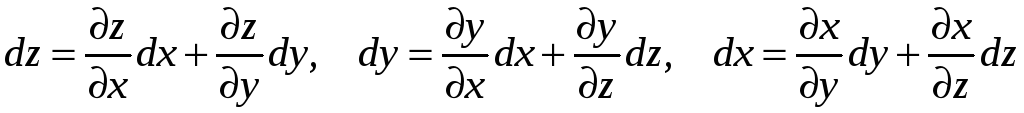
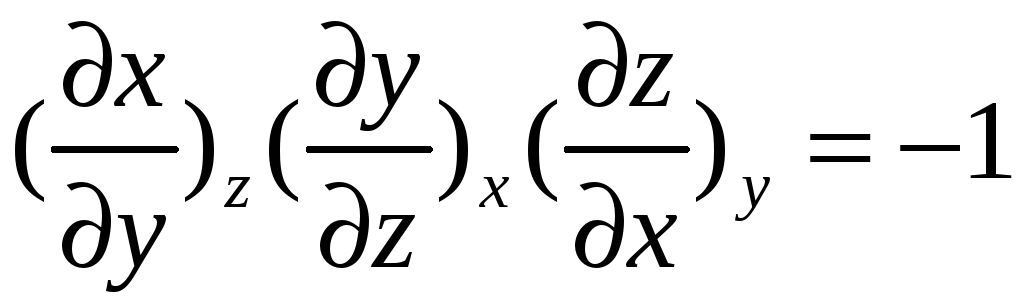 .
.
Если
![]() ,
то
,
то
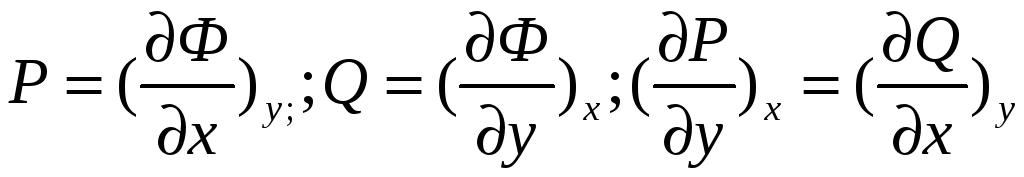
![]() – термодинамическое
тождество.
– термодинамическое
тождество.
Энтальпия:
![]()
Энтропия:
![]()
Свободная
энергия:
![]()
Т/Д
функция Гиббса:
![]()
![]()
![]()
![]()
![]()
-
Взаимодействие молекул. Идеальный газ. Основные газовые законы.
Столкновения делятся на упругие и неупругие.
U
– потенциальная энергия взаимодействия
частиц:
![]() .
.
Идеальный газ – это такая модель газа, для которой выполняется:
1) U = 0;
2) столкновения между молекулами газа – упругие;
3) молекулы газа – материальные точки.
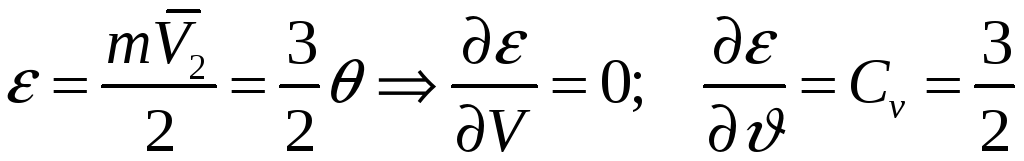 ,
, ![]() – внутренняя энергия.
– внутренняя энергия.
Уравнения состояния: (Клапейрона-Менделеева):
![]() ,
, ![]() ,
, ![]() ,
, 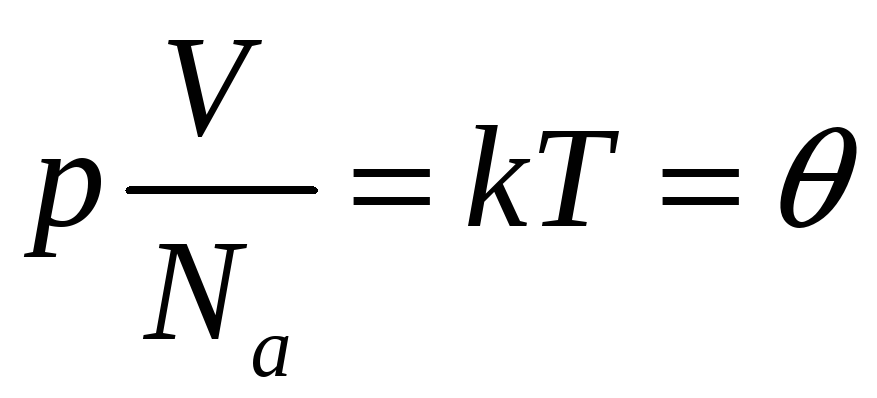 ,
, ![]()
Г
 азовые
законы:
азовые
законы:
1)
![]() – закон Бойля-Мариотта
– закон Бойля-Мариотта
2)
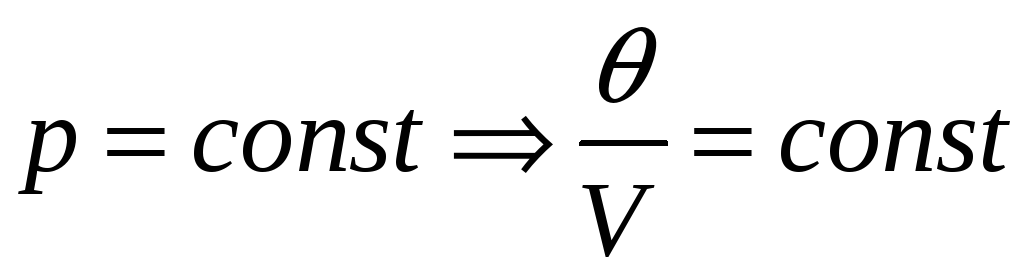 – закон Гей-Люссака
– закон Гей-Люссака
3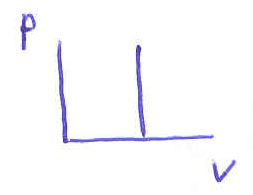 )
)
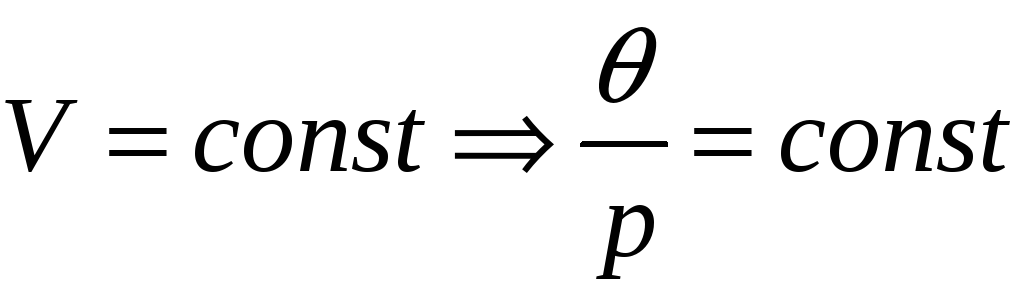 – закон Шарля.
– закон Шарля.
-
Распределение молекул газа по скоростям. Идеальный газ во внешнем потенциальном поле.
Распределение Максвелла:
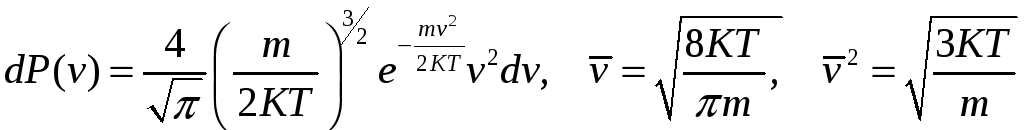 .
.
Распределение Больцмана.
Путь
![]() – потенциал внешнего поля.
– потенциал внешнего поля.
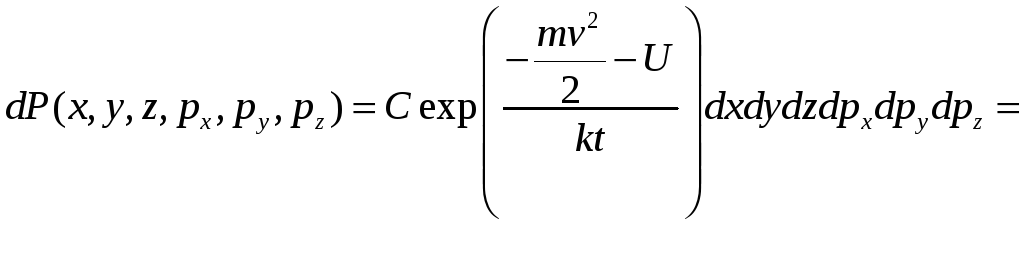
 ,
где n
– число частиц.
,
где n
– число частиц.
Тогда получится:
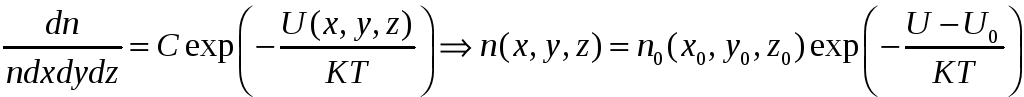
– это и есть распределние Больцмана
-
Канонические распределения.
Пусть
есть система с энергией
![]() ,
числом частиц
,
числом частиц![]() ,
и параметром
,
и параметром
![]() .
.
1. Дискретный спектр энергий :
В этом случае
![]() ,
,
где
![]() – квазикронекеровская функция, n
– микрокопическое состояние,
– квазикронекеровская функция, n
– микрокопическое состояние,
![]() – статистический
вес.
– статистический
вес.
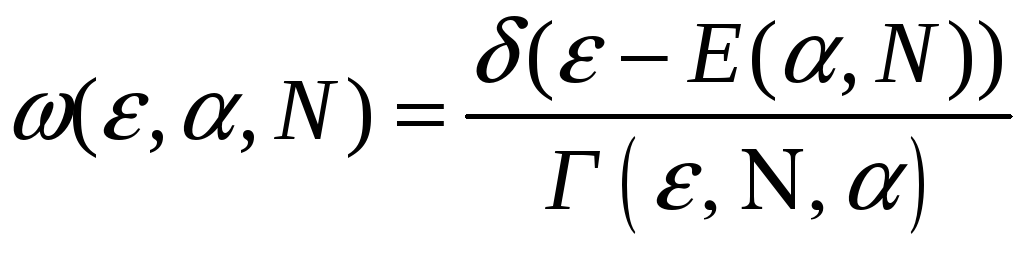 – микроканоническое
распределение Гиббса.
– микроканоническое
распределение Гиббса.
![]() – энтропия.
– энтропия.
![]() .
.
2. Распределение Гиббса.
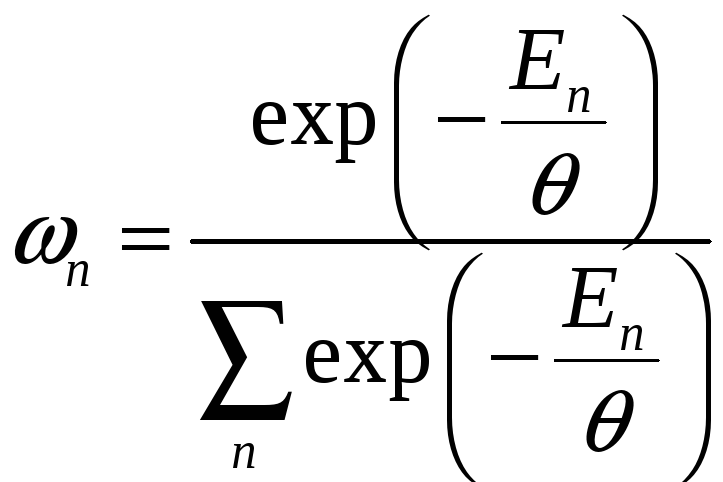 ;
;
![]() – свободная
энергия.
– свободная
энергия.
3. Большое каноническое распределение (для ):
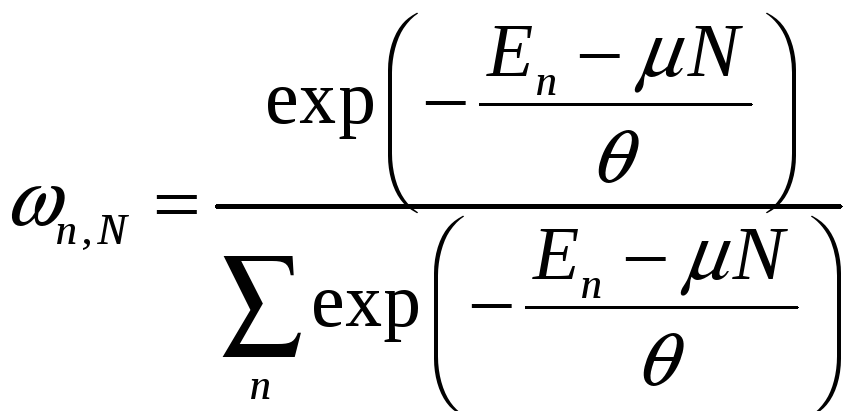 .
.
-
Идеальный Бозе- и Ферми-газы. Равновесное излучение.
Ферми – Газ
![]() – число
частиц с энергией
– число
частиц с энергией
![]() .
.
Плотность
вероятности:
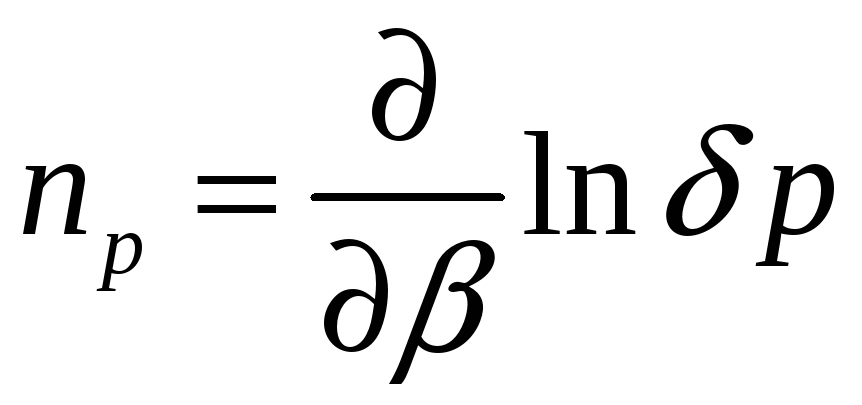 ,
,
где
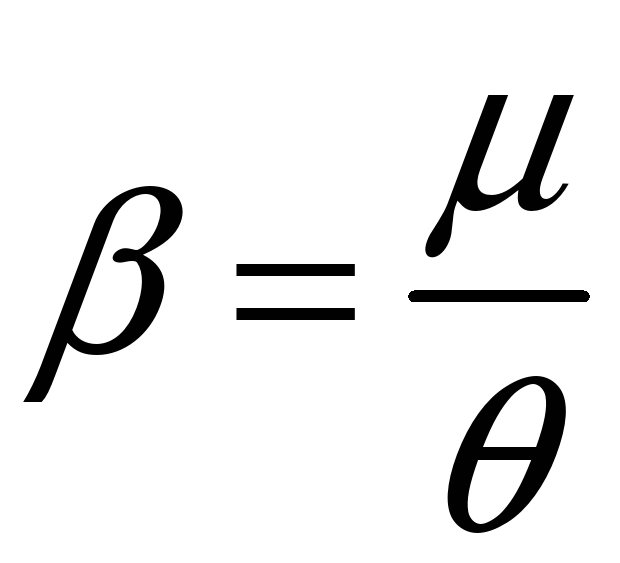 ,
,
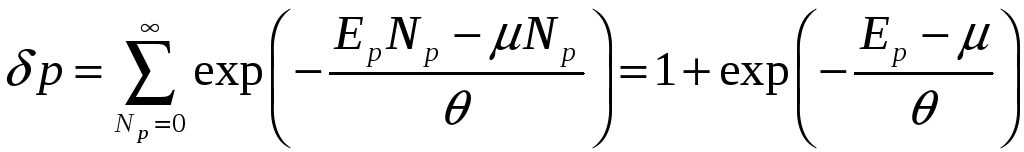
(для
первого слагаемого
![]() ,
для второго –
,
для второго –
![]() ).
).

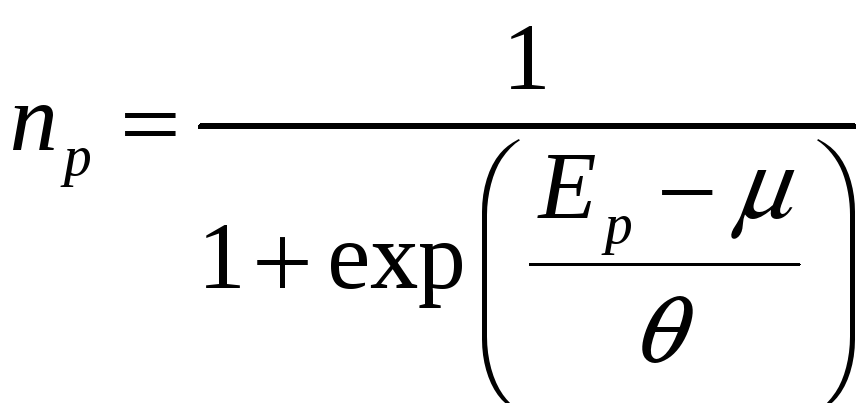
Бозе
– газ.
![]()
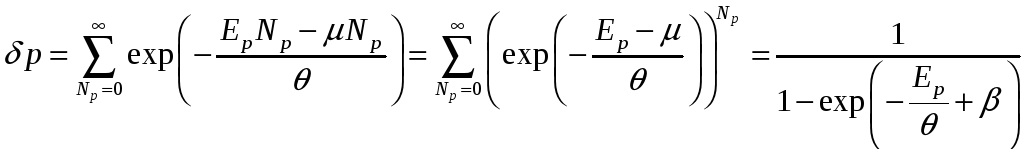
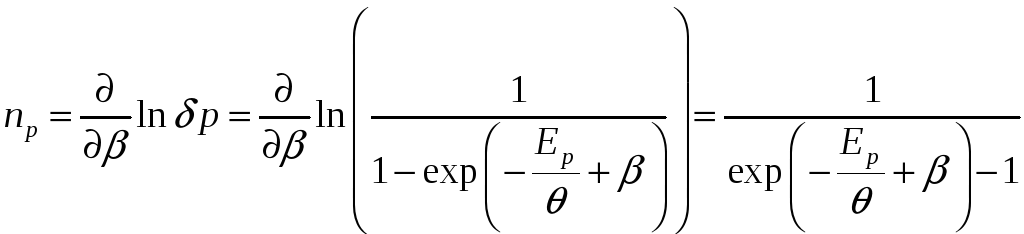 .
.
Равновесное излучение.
![]() ,
,
![]() ,
где
,
где
![]()
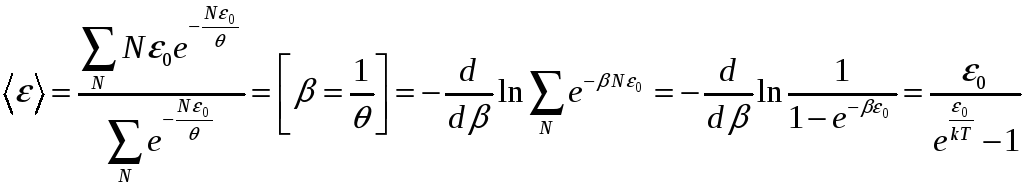 ,
,
![]() ,
,
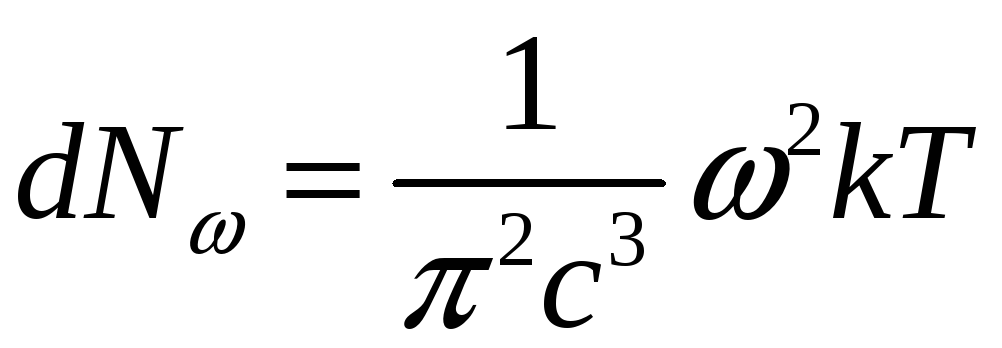 ;
;
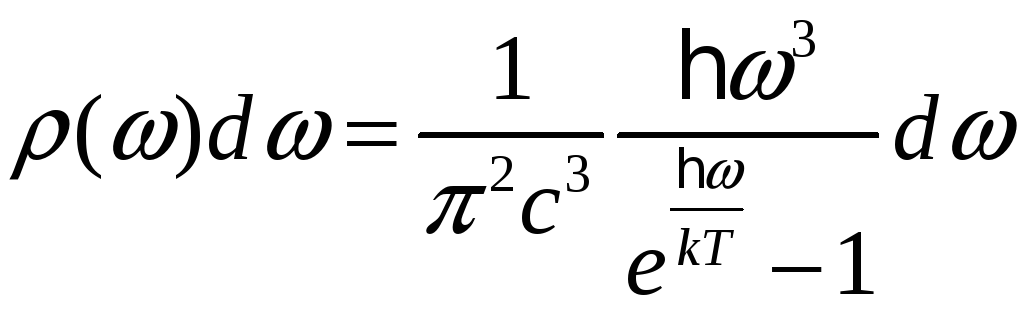
-
Теплоемкость твердых тел. Модели Дебая и Эйнштейна.
Теплоемкость твердого тела.
Теплоемкость
при постоянном объеме определяется
соотношением:
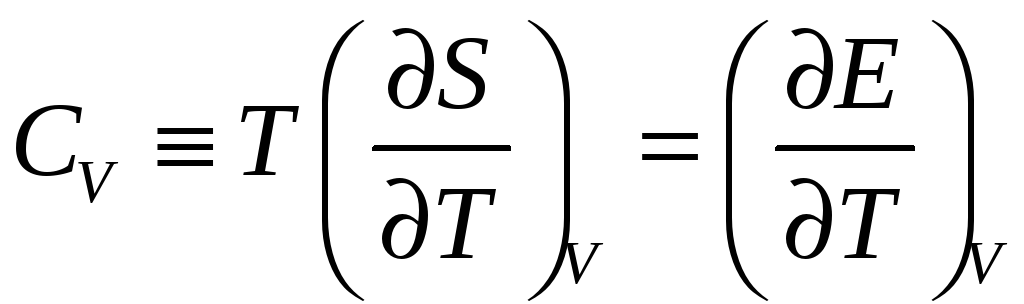 ,
где
,
где
![]() – энтропия,
– энтропия,
![]() – внутренняя энергия,
– внутренняя энергия,
![]() – абсолютная температура.
– абсолютная температура.
-
При комнатных температурах значение теплоемкости почти всех твердых тел близки к
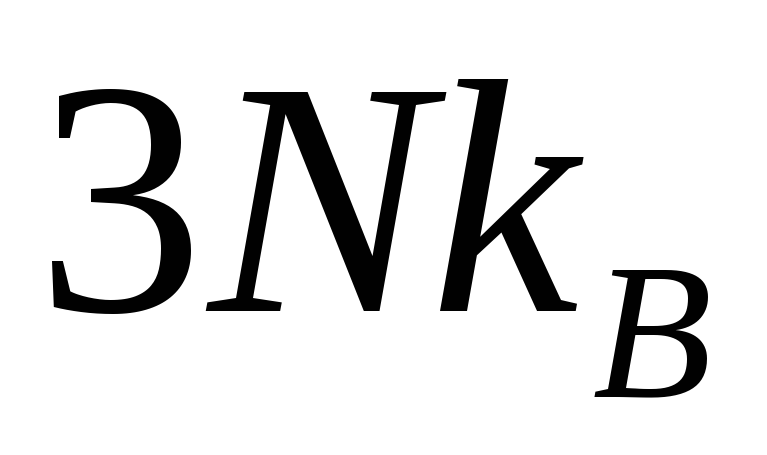 .
. -
При низких температурах теплоемкость заметно уменьшается, и в области абсолютного нуля температур приближается к нулю по закону
 для диэлектриков и по закону
для диэлектриков и по закону
 для металлов; если металл переходит в
сверхпроводящие состояние, то закон
уменьшения теплоемкости более резкий,
чем
для металлов; если металл переходит в
сверхпроводящие состояние, то закон
уменьшения теплоемкости более резкий,
чем
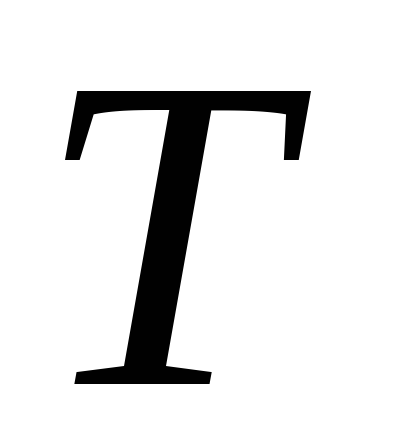 .
.
Модель Эйнштейна.
Средняя
энергия линейного осциллятора с частотой
![]() равна
равна
![]() .
Энергия
.
Энергия
![]() системы
из
системы
из
![]() одномерных осцилляторов, имеющих одну
и туже резонансную частоту
одномерных осцилляторов, имеющих одну
и туже резонансную частоту
![]() ,
равна просто сумме энергий осцилляторов:
,
равна просто сумме энергий осцилляторов:
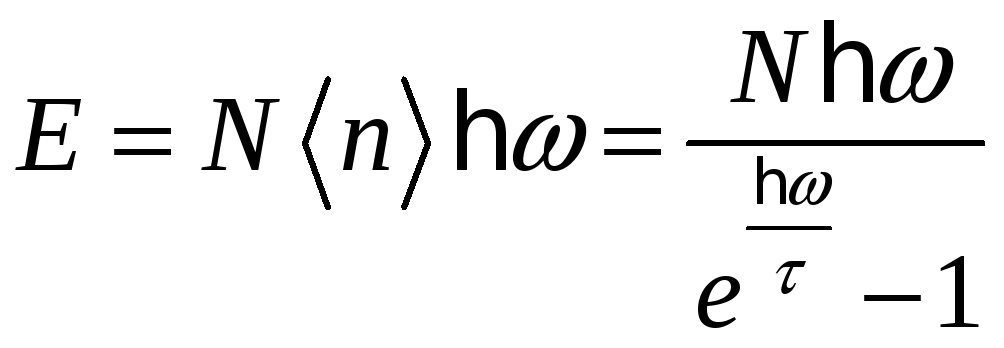
Тогда
теплоемкость
![]() этой системы осцилляторов:
этой системы осцилляторов:
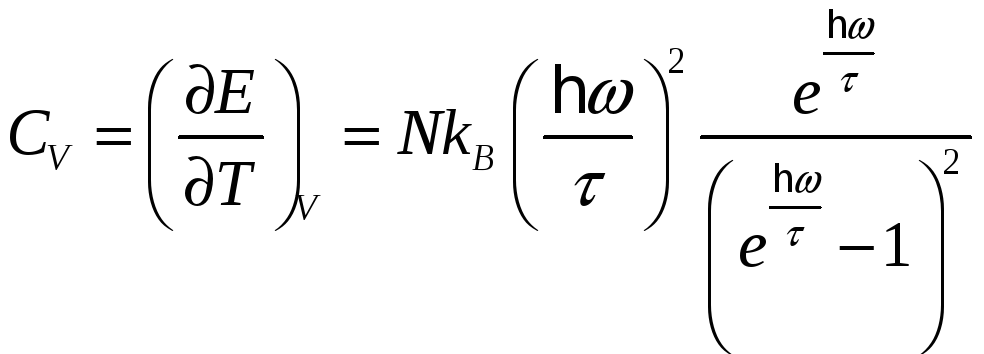
Таков,
по эйнштейновской модели, вклад, который
дают
![]() осцилляторов одинаковой частоты в
теплоемкость твердого тела. Если вместо
осцилляторов одинаковой частоты в
теплоемкость твердого тела. Если вместо
![]() взять
взять
![]() (поскольку каждый из
(поскольку каждый из
![]() атомов имеет три степени свободы), и
предельный случай приведенной выше
формулы, отвечающий высоким температурам,
то мы получим
атомов имеет три степени свободы), и
предельный случай приведенной выше
формулы, отвечающий высоким температурам,
то мы получим
![]() .
.
Модель
Дебая.
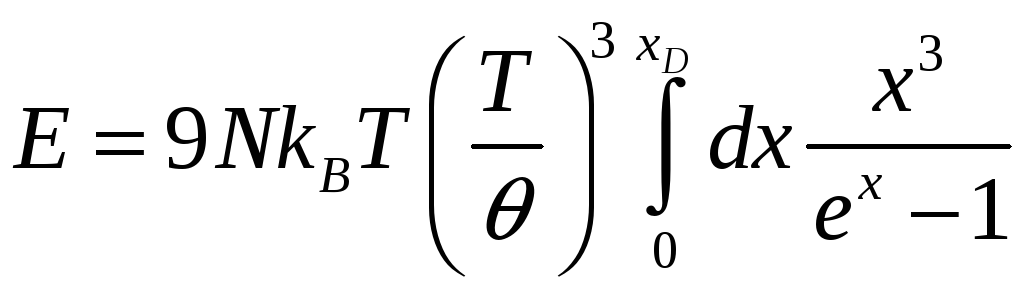 ,
где
,
где
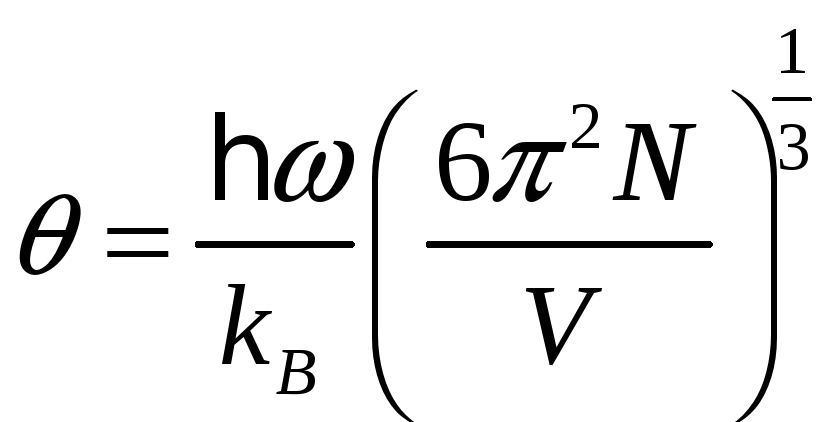 – температура Дебая,
– температура Дебая,
![]() – число атомов образца,
– число атомов образца,
![]()
Тогда
теплоемкость
![]() этой системы определяется как:
этой системы определяется как:
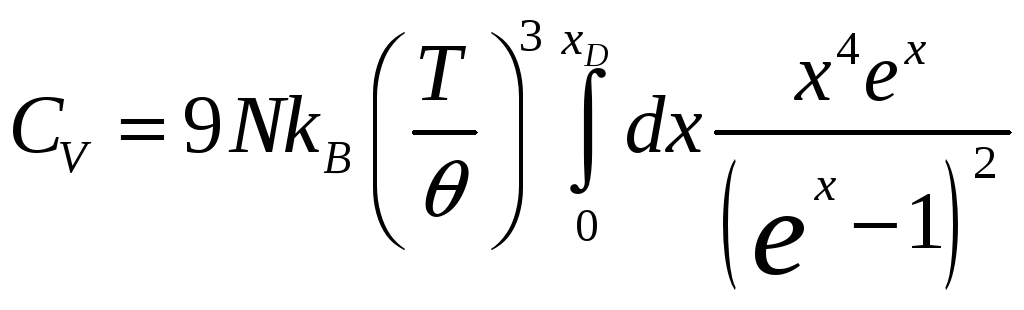 .
.
При
очень низких температурах, т.е. положив
верхний придел равным
![]() :
:
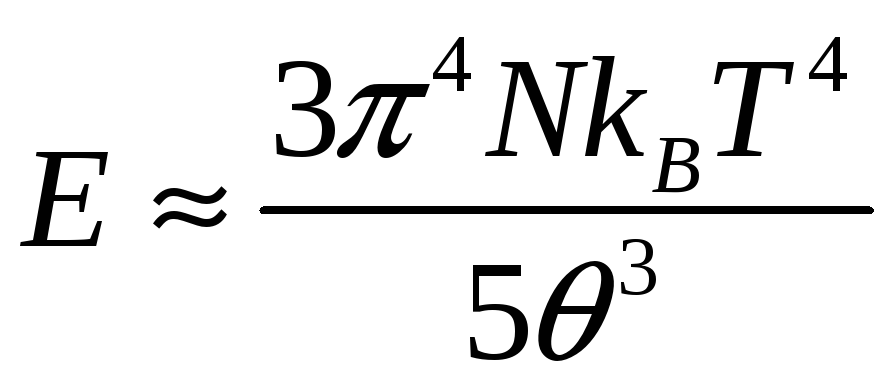 при
при
![]() ,
,
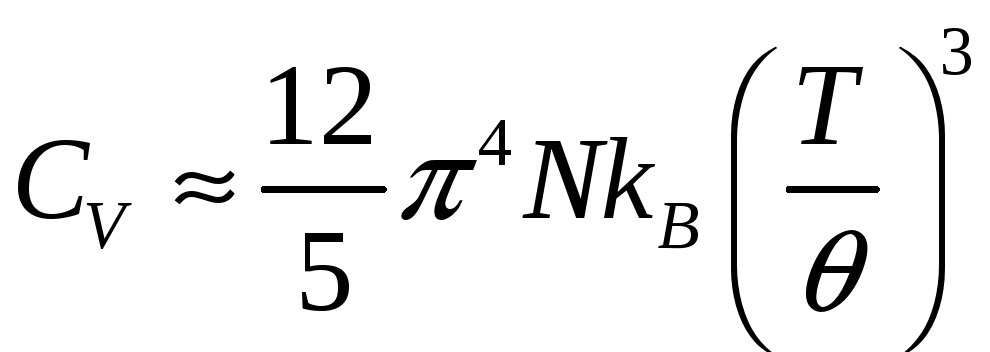 .
.
