
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Добування кисню:
|
У промисловості |
У лабораторії |
|
розділенням зрідженого повітря,електролізом води. 2Н2О=2Н2+О2
|
KClO3=2KCl+O2 2KMbO4=K2MnO4+MnO2+O2 2KNO3=2KNO3+O2 2Hg=2Hg+O2 2H2O2=2H2O+O2
|
Хімічні властивості кисню
*допишіть рівняння реакцій
1)взаємодіє з металами (за винятком золота, платини та платинових металів) з утворенням оксидів і пероксидів:
4Li + O2 =
6Na + 2O2 =
4K + 3O2 =
3Ba + 2O2 =
2Mg + O2 =
2Ca + O2 =
3Fe + 2O2 =
2)взаємодієзусіманеметалами (крімгалогенів) зутвореннямкислотнихабонесолетвірнихоксидів:
S + O2 =
4P + 5O2 =
2C + O2 =
3)взаємодієізскладнимиорганічнимитанеорганічнимиречовинамизутвореннямоксидів:
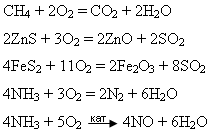
На кисень припадає близько 49% маси земної кори,вміст у повітрі-21%,він входить до складу білків,жирів,вуглеводів.
Застосування кисню:
-випалювання сульфідних руд
-для функціонування паливних печей
-дихання
-добування кислот
-вмедицині
Озон
Молекула озону O3(OO2) складається з трьох атомів Оксигену .
Один з атомів Оксигену виявляє ступінь окиснення +4 (О+4О2-2).
Фізичні властивості.
Озон – газ синього кольору із своєрідним різким запахом, розчинність у воді майже в 7 разів вища, ніж у кисню. Отруйний навіть у малих концентраціях.
|
|
Хімічні властивості озону.
Озон – дуже сильний окисник. Він дуже активний. Це пояснюється тим, що озон – нестійка сполука, він легко розкладається з утворенням атомів Оксигену:
O3 = O2+O.............2O = O2
Атоми Оксигену хімічно активніші за молекули кисню. Тому озон виявляє сильніші окисні властивості, ніж кисень
окиснює плюмбум сульфід, перетворюючи його на сульфат:
![]()
витісняє йод із водного розчину йодидів – це якісна реакція на озон:
![]()
Добування озону.
У лабораторії озон добувають дією електричних розрядів на кисень у приладах, що називаються озонаторами:
![]() Озон
реагує так само як кисень,але реакції
за його участі проходять енергійніше,тому
що при його розкладі утворюється
атомарний кисень: О3=О2+О
Озон
реагує так само як кисень,але реакції
за його участі проходять енергійніше,тому
що при його розкладі утворюється
атомарний кисень: О3=О2+О
Якісна реакція на озон:
2KI+O3+H2O=I2+2KOH+O2
Властивості кисню й озону
|
Властивості простих речовин |
Прості речовини |
|
|
кисень |
озон |
|
|
Агрегатний стан за звичайних умов |
Газ |
Газ |
|
Колір |
Безбарвний |
Синій |
|
Запах |
Без запаху |
Різкий, своєрідний |
|
Розчинність (у 100 об'ємах Н20 при 200С) |
3 об'єми |
49 об'ємів |
|
Густина газу за н. у. |
1,43 г/л |
2,14 г/л |
|
Температура кипіння |
-193 °С |
-112 °С |
|
Температура плавлення |
-219 °С |
-192 °С |
|
Фізіологічна дія |
Неотруйний |
Дуже отруйний |
|
Хімічні властивості |
Окисник |
Дуже сильний окисник |
|
Реакційна здатність |
Висока |
Дуже висока |
