
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
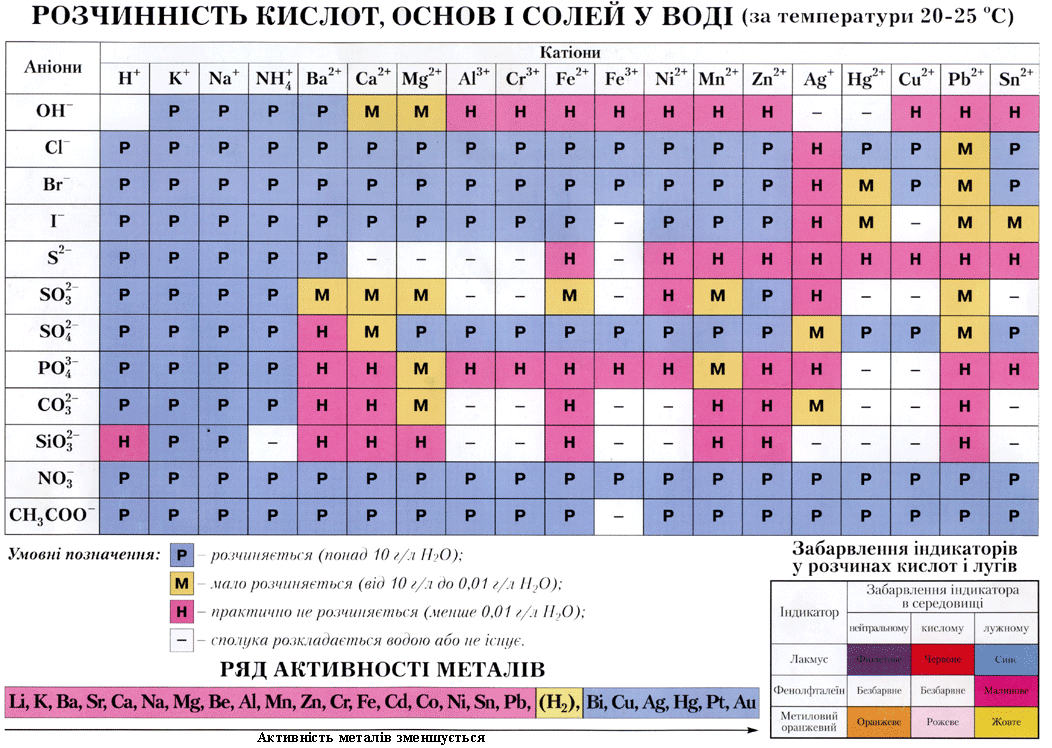
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
УКООПСПІЛКА
Коледж економіки і права
Вінницького кооперативного інституту

Конспект лекцій
з хімії

Студент(ка) ____групи_________
Спеціальність:________________
_____________________________
_____________________________
Викладач:____________________
Вінниця 2011-2012н.р
Хімія. Конспект лекцій та лабораторних робіт з хімії для студентів кооператиного коледжу. Спеціальності: 5.03051001 «Бухгалтерський облік», 5.05170101 «Виробництво харчової продукції», 5.03050702 «Комерційна діяльність», 5.03050801 « Фінанси і кредит» спеціалізація «Банківська справа» , 5.03050802 «Оціночна діяльнісь», 5.03051001 «Товарознавство та комерційна діяльність», 5.03040101 «Правознавство», 5.14010102 "Ресторанне обслуговування"
Укладачі:
Пукас М.М.,Ребікова А.А. – викладачі Коледжу економіки і права Вінницького кооперативного інституту.
Конспект лекцій та лабораторних робіт з хімії розглянуто та схвалено на засіданні циклової комісї загальноосвітніх дисциплін.
Протокол № ___ від „___” ________ 20 р.
Голова циклової комісії Тарасова О.З.
Повторення основних питань курсу хімія
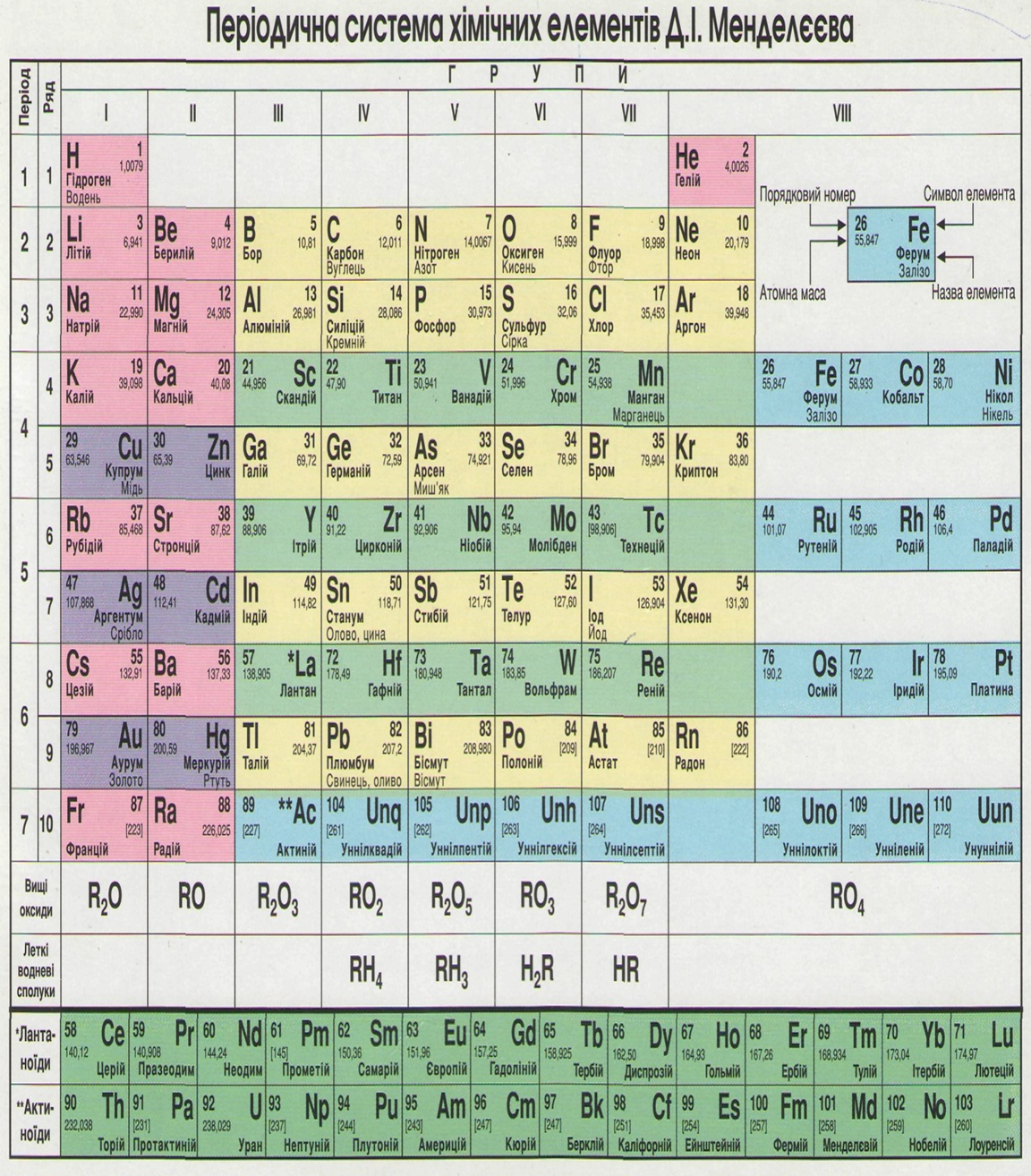
Періодичний закон і періодична система хімічних елементів Д.І.Менделєєва у світлі теорії про будову атома.
Властивості хімічних елементів, а також форми й властивості сполук елементів перебувають у періодичній залежності від величин зарядів ядер їхніх атомів (протонних чисел).
Період – це сукупність (ряд) хімічних елементів, побудований в порядку зростання заряду ядер атомів, який починається (крім першого) активним лужним металом і закінчується благородним газом.
Періоди діляться на малі і великі.
Малі періоди: 1, 2, 3,- мають відповідно 2, 8, 8 елементів.
Великі періоди: 4, 5, 6, - мають відповідно 18, 18, 32 елементів. 7 великий період незавершений.
За подібністю хімічних властивостей елементи в таблиці поділяються на 8 груп, які складаються з двох підгруп: головної і побічної. Головні підгрупи містять елементи малих і великих періодів,
До побічних підгруп входять елементи тільки великих періодів: 4, 5, 6, 7, - які мають металічні властивості
• порядковий номер хімічного елемента вказує на величину заряду ядра атома, кількість протонів у ядрі — на кількість електронів у електронній оболонці атома;
• кількість нейтронів у ядрі атома дорівнює різниці між відносною атомною масою хімічного елемента та його порядковим номером;
• номер періоду збігається з кількістю енергетичних рівнів (електронних шарів) в електронній оболонці атома;
• хімічні елементи однієї підгрупи мають однакову електронну формулу зовнішнього енергетичного рівня (електронного шару);
• в елементів головних підгруп кількість електронів на зовнішньому енергетичному рівні збігається з номером групи;
• вища валентність атомів хімічного елемента в оксидах дорівнює номеру групи (існують винятки);
• кількість неспарених електронів в атомах неметалічних елементів У-УІІ груп можна визначити дією віднімання: 8 — номер групи.
*Скільки повністю заповнених енергетичних рівней мають атоми літію, натрію, калію, хлору та брому. Складіть електронні формули атомів вказаних елементів.
*Скласти електронну формулу атомів із слідуючими порядковими номерами: 13,27,8. Визначити склад ядер атомів елементів, будова валентного рівня яких має слідуючі формули; 3d2 2s1; 3s23p2; 4s2 4р2.
*Користуючись алгоритмом ,охарактеризувати такі елементи за їх місце розташуванням у періодичній системі:
Кальцій ,Барій,Калій,Сульфур,Хлор.
Характеристика елемента за його місцем у ПС
1. Номер групи,періоду.
2. Порядковий номер, атомна маса.
3.Кількість протонів,електронів,нейтронів.
4. Кількість енергетичних рівнів
5 Кількість валентних електронів.
6. Розписати електрони по енергетичних рівнях.
7. Вказати можливі ступені окиснення.
8.. Формула вищого оксиду.
9. Формула можливої сполуки з воднем.
10.Електронегативність по відношенню до його сусідів.
11. Метал чи неметал
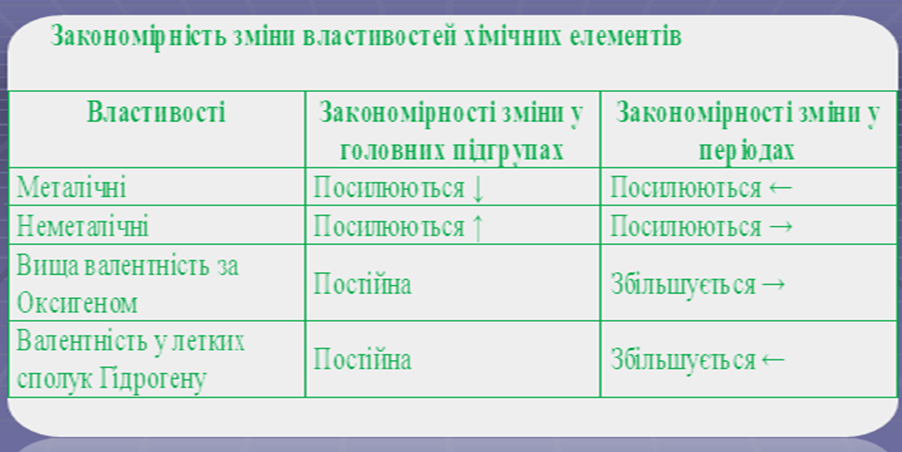
Електронегативність – умовна величина, що характеризує здатність атома в хімічній сполуці притягувати до себе електрони.
Валентність – це здатність атома хімічного елемента приєднувати певне число атомів інших хімічних елементів
