
- •Глава 2. Основные положения молекулярно-кинетической теории вещества
- •2.1. Молекулы, их поведение, масса, моль, число Авогадро
- •2.2. Основные законы гидростатики.
- •2.3. Применение основных законов гидростатики и аэростатики в физических измерениях
- •2.4. Закон идеального газа
- •2.5. Фазовые переходы
- •2.6. Основные положения термодинамики
- •2.7.Тепловые методы измерения вакуума
2.6. Основные положения термодинамики
Термодинамика – наука о закономерностях превращения энергии. В термодинамике широко используется понятие термодинамической системы. Термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой.
При использовании термодинамического подхода мы не интересуемся что происходит внутри системы (т.е. как двигаются частицы и т.д.), а изучаем энергетическое состояние системы и его изменения и на основе законов сохранения энергии (в данном случае они называются началами термодинамики) можем определить макроскопические параметры системы.
Внутренняя энергия системы – энергия хаотического (теплового) движения микрочастиц и энергия их взаимодействия. Для идеального газа она равна сумме кинетических энергий хаотического движения всех молекул. Внутренняя энергия состоит: суммы кинетических энергий хаотического движения молекул в Ц-системе (система как целое покоится); суммы потенциальных энергий взаимодействия молекул внутри молекул; суммы внутренних энергий самих молекул, атомов, ядер. Внутренняя энергия является функцией состояния системы и не зависит от пути перевода в это состояние. Внутреннюю энергию можно изменить двумя способами - совершить работу над системой внешними силами или осуществить теплопередачу.
Начала (законы) термодинамики — совокупность постулатов, лежащих в основе термодинамики. Теплота представляет собой особую форму энергии и должна учитываться в законе сохранения и превращения энергии.
Первое начало термодинамики представляет собой закон сохранения энергии в применении к термодинамическим системам. Количество тепла, сообщаемого системе, расходуется на изменение её внутренней энергии и на совершение ею работы против внешних сил Q=∆U+A. (работа совершается системой).
Или Изменение внутренней энергии системы равно сообщаемому ей количеству тепла и работе, совершаемой внешними силами над системой.. ∆U=Q+A´ (A´ - работа совершается над системой A´= -А).
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Второе начало термодинамики показывает, что невозможно всю внутреннюю энергию тела превратить в полезную работу. Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения. Существуют несколько эквивалентных формулировок второго начала термодинамики:
Невозможна самопроизвольная передача теплоты от холодного тела к теплому. (1)
Никакой двигатель не может преобразовывать теплоту в работу со стопроцентной эффективностью. (2)
В замкнутой системе энтропия не может убывать. (3)
Первая формулировка второго начала термодинамики логически вытекает из поведения молекул, поскольку теплота отражает кинетическую энергию молекул и при соударении более быстрые молекулы замедляются, а более медленные ускоряются.
Поскольку теплота, отражающая кинетическую энергию молекул, представляет собой одну из форм энергии, она тоже может быть преобразована в работу. Но опять мы имеем дело с направленным процессом. Перевести работу в теплоту можно со стопроцентной эффективностью. Вторая формулировка второго начала термодинамики утверждает, что обратный процесс невозможен. Сколько ни пытайтесь всю тепловую энергию превратить в работу — тепловые потери в окружающую среду неизбежны.
Третья формулировка связана с понятием энтропии и гласит, что в замкнутой системе энтропия уменьшаться не может, что опять же указывает на направленность процессов.
Тепловые машины. Для преобразования тепловой энергии в работу служат тепловые машины, в которых используются термодинамические циклы.
Термодинамические циклы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия) совпадают.
Для
того, чтобы управлять состоянием рабочего
тела, в тепловую машину входят нагреватель
и холодильник (рис.2.18). В каждом цикле
рабочее тело забирает некоторое
количество теплоты (Q1)
у нагревателя и отдает количество
теплоты Q2
холодильнику. Работа, совершенная
тепловой машиной в цикле, равна, таким
образом, A-(Q1-Q2)-∆U=
Q1-Q2,так
как изменение внутренней энергии в
круговом процессе равно нулю (это функция
состояния). При этом нагреватель потратил
энергию Q1.
Поэтому коэффициент полезного действия
тепловой машины (отношение полезной
работы к затраченной энергии) равен
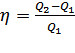 .
.

Наибольшей эффективностью обладает цикл Карно, который состоит из двух изотер и двух адиабат, что иллюстрируется рисунком 2.19. Можно показать, что КПД тепловой машины Карно максимален в том смысле, что никакая тепловая машина с теми же температурами нагревателя и холодильника не может обладать бо́льшим КПД. КПД обратимых двигателей, работающих по циклу Карно зависит только от температуры холодильника и нагревателя ( не зависит от вида двигателя и рода вещества). КПД не зависит от выбора термометрического тела, а определяется только отношением температур теплоотдатчика и теплоприемника, причем к.п.д. всегда меньше 1. Q1/Q2=T2/T1 – это отношение имеет вполне определенное значение, не зависящее от выбора эмпирической шкалы температур. Поэтому Кельвин предложил значение этого отношения считать отношением соответствующих абсолютных термодинамических температур. Выбранная с помощью этого соотношения шкала температур называется абсолютной термодинамической шкалой, а температура – абсолютной термодинамической температурой.
 Эта
шкала совпадает со шкалой идеального
газового термометра и с температурой,
которая была введена в виде параметра,
как мера средней кинетической энергии
молекул.
Эта
шкала совпадает со шкалой идеального
газового термометра и с температурой,
которая была введена в виде параметра,
как мера средней кинетической энергии
молекул.
Из указанного выше отношения следует. что температура всегда одного знака. Из законов термодинамики следует, что она должна быть всегда положительной, отрицательная температура невозможна. Анализ различных процессов показывает, что 0К недостижим. хотя не исключается возможность приближения к нему с любой точностью. Недостижимость 0 принимается в термодинамике как самостоятельный постулат и формулируется третьим началом термодинамики.
