
- •Глава 2. Основные положения молекулярно-кинетической теории вещества
- •2.1. Молекулы, их поведение, масса, моль, число Авогадро
- •2.2. Основные законы гидростатики.
- •2.3. Применение основных законов гидростатики и аэростатики в физических измерениях
- •2.4. Закон идеального газа
- •2.5. Фазовые переходы
- •2.6. Основные положения термодинамики
- •2.7.Тепловые методы измерения вакуума
2.5. Фазовые переходы
Взаимодействие молекул. Как предположил Ван-дер-Ваальс, между молекулами существуют силы взаимодействия. И атом и молекула представляют собой систему электрических зарядов. Между электрическими зарядами существуют силы притяжения (если заряды разноименные) и отталкивания (у одноименных зарядов). Следовательно, силы взаимодействия между молекулами носят электромагнитный характер. Эти силы зависят от расстояния. На графике (рис.2.8) изображены зависимости этих сил от расстояния. На определенном расстоянии силы притяжения и отталкивания равны, что соответствует равновесному положению молекул. При отклонении от этого положения возникают силы, стремящиеся восстановить равновесное состояние. Из рисунка видно, что на малых расстояниях преобладают силы отталкивания, на больших – силы притяжения. рис. зависимость силы взаимодействия и потенциальной энергии от расстояния между молекулами. Эти силы обуславливают наличие потенциальной энергии молекул, которая в положении равновесия минимальна.
Агрегатные состояния вещества - состояния одного и того же вещества в различных интервалах температур и давлений. Традиционно агрегатными считают газообразное, жидкое и твердое состояния, переходы между которыми сопровождаются скачкообразными изменениями свободной энергии вещества, энтропии, плотности и других физических характеристик. При температуре выше 0К вследствие теплового движения молекулы совершают малые колебания около равновесных положений, в процессе которых силы притяжения сменяются силами отталкивания и наоборот.
Если вещество находится при низкой температуре, частицы его образуют правильную геометрическую структуру, в таком случае энергия связей между частицами, которые не нарушают образовавшуюся структуру, больше энергии тепловых колебаний - вещество существует в твердом состоянии. В твердом теле все (точнее, почти все) молекулы длительно (иногда тысячелетиями) сохраняют взаимное расположение, совершая лишь небольшие колебания около определенных положений равновесия.
При повышении температуры энергия тепловых колебаний частиц возрастает, и для каждого вещества имеется температура, начиная с которой энергия тепловых колебаний превышает энергию связей. Частицы могут совершать различные движения, смещаясь относительно друг друга. Они еще остаются в контакте, хотя правильная геометрическая структура частиц нарушается - вещество существует в жидком состоянии.
При высокой температуре тепловые колебания увеличиваются настолько, что частицы становятся практически не связанными друг с другом. Вещество переходит в газообразное или парообразное состояние. В паре, подобно газу, можно почти не учитывать сил сцепления и рассматривать движение как свободный полет молекул и соударение их друг с другом и с окружающими телами (стенками и жидкостью, покрывающей дно сосуда).
Итак, при повышении температуры вещества переходят из упорядоченного состояния (твердое) в неупорядоченное состояние (газообразное); жидкое состояние является промежуточным.
Переход
из одного агрегатного состояния в
другое.
Так как, в различных агрегатных состояниях
внутренние энергии различны, то переход
из одного состояния в другое сопровождается
выделением или поглощением тепла.
Скорость испарения различных веществ
различна. Для того чтобы молекула
жидкости, находящаяся в поверхностном
слое, могла вылететь за ее пределы,
кинетическая энергия молекулы должна
быть больше, чем работа (работа выхода),
которую нужно при этом затратить против
сил сцепления, тянущих ее внутрь жидкости.
(При комнатной температуре для этого
требуется энергия в 5-15 раз больше средней
кинетической, в противном случае жидкость
бы испарилась мгновенно). Поэтому только
те молекулы, которые имеют в данный
момент достаточную скорость, смогут
вылететь из поверхностного слоя жидкости
наружу. Сталкиваясь с другими молекулами,
часть вылетевших молекул возвращается
обратно. Если вылетает больше молекул,
чем возвращается обратно, жидкость
испаряется. В противном случае происходит
конденсация пара. Если же число вылетающих
из жидкости молекул равно (в среднем)
числу возвращающихся, получается
подвижное равновесие пара и жидкости
и пар становится насыщенным. Насыщенным
называется пар в состоянии термодинамического
равновесия с жидкостью.
Между газом и паром нет принципиальной разницы, следовательно, пар должен подчиняться тем же законам, что и газ. Для идеального газа зависимость давление при постоянном объеме прямо пропорционально температуре. Из графика, представленного на рис.2.9 видно, что зависимость давления насыщенного пара от температуры является нелинейной, что отличает ее аналогичной зависимости для идеального газа. Отклонение объясняется тем, что закон Бойля-Мариотта справедлив для постоянной массы газа, в то время как с повышением температуры изменяется не только скорость молекул, но и доля молекул, кинетическая энергия которых больше работы выхода, т.е. масса пара. Испарение теплой жидкости идет интенсивнее, чем холодной. График на рис.2.9 также называют фазовой диаграммой вещества, в данном случае воды. Переход из одного агрегатного состояния в другое называют фазовым переходом.
Фаза – физически однородная часть вещества, отделенная от другой части границей раздела. Если точка находится под кривой, то вещество является паром, если над кривой, то жидкостью. Соответственно переход через линию разграничения фаз снизу вверх соответствует процессу конденсации, а наоборот – кипению. Точки на самой кривой означают, обе фазы воды, жидкость и пар, находятся в равновесии, вода является как бы одновременно и жидкостью и паром. Соответственно все точки под кривой отображают состояние ненасыщенного пара. Зависимость, отраженная на графике является нелинейной - приращение давления, соответствующее увеличению температуры на 1К, растет с температурой.
В отличие от испарения, которое происходит при любой температуре жидкости, другой вид парообразования - кипение - возможен лишь при совершенно определенной (при данном давлении) температуре - температуре кипения. Испарение происходит не только с поверхности жидкости, но и внутри нее, т.к. практически всегда жидкость содержит растворенный воздух. Испарение внутрь таких пузырьков приводит к их росту и всплыванию. При равенстве давлений насыщенного пара внутри пузырька и внешнего давления происходит высвобождение в паровую фазу над жидкостью – происходит процесс кипения. При повышении внешнего давления температура кипения повышается.
Зависимость температуры кипения от давления дает способ измерения атмосферного давления. Измерив температуру кипения воды, можно по таблицам давления пара при разных температурах судить об атмосферном давлении. Специально приспособленные для таких измерений термометры называют гипсотермометрами. Они устроены так, что дают возможность отсчитывать температуру около 100°С с большой точностью. Различие температур кипения веществ связано с различием в давлении пара при одной и той же температуре. Пар эфира уже при комнатной температуре имеет давление, превышающее половину атмосферного. Поэтому, чтобы давление пара эфира достигло атмосферного, нужно небольшое повышение температуры (до 35°С). Иначе дело обстоит, например, у ртути, имеющей при комнатной температуре совсем ничтожное давление. Давление пара ртути делается равным атмосферному только при значительном повышении температуры (до 357 °С).
Если график рис.2.9 инвертировать (поменять местами переменные), то получится зависимость температуры кипения от атмосферного давления (рис.2.10), поскольку при кипении давление пара сравнивается с атмосферным (давлением воздуха). Во время кипения температура жидкости и пара над ней не меняется. Она сохраняется неизменной до тех пор, пока вся жидкость не выкипит.
Д ля
осуществления перехода из жидкой фазы
в газообразную к системе необходимо
подводить теплоту без изменения
температуры системы. Эта теплота идет
на изменение фазового состояния вещества
и называется скрытой теплотой испарения
или просто теплотой испарения. Скрытая
теплота затрачивается на совершение
работы против сил притяжения, между
молекулами.
ля
осуществления перехода из жидкой фазы
в газообразную к системе необходимо
подводить теплоту без изменения
температуры системы. Эта теплота идет
на изменение фазового состояния вещества
и называется скрытой теплотой испарения
или просто теплотой испарения. Скрытая
теплота затрачивается на совершение
работы против сил притяжения, между
молекулами.
Переход в другое агрегатное состояние сопровождается поглощением или выделением тепла. Количественная оценка этого тепла выражается в виде физической величины – теплота парообразования, теплота плавления – количество энергии необходимое для протекания изотермических процессов.
Удельной
теплотой парообразования (испарения)
называется количество тепла, которое
надо сообщить единице массы жидкости,
находящейся при температуре Т,
чтобы перевести ее в пар при той же
температуре. ![]() - удельная теплота парообразования
- удельная теплота парообразования
![]() .
Количество теплоты, необходимое для
превращения жидкости в пар Qn=rm.
.
Количество теплоты, необходимое для
превращения жидкости в пар Qn=rm.
Скрытая теплота испарения является количественной характеристикой сил связи между молекулами жидкости. Чем больше эти силы, тем больше скрытая теплота испарения. При испарении средняя энергия этих молекул жидкости убывает, следовательно, жидкость охлаждается. Особенно сильное охлаждение получается, если испарение происходит очень быстро, так что испаряющаяся жидкость не успевает получать теплоту от окружающих тел. На этом факте основан способ понижения температуры: заставляя жидкость, помещенную в сосуд с нетеплопроводными стенками, усиленно испаряться, можно ее значительно охладить. При парообразовании увеличение внутренней энергии вещества происходит в основном благодаря тому, что при переходе в пар среднее расстояние между молекулами увеличивается. При этом возрастает их взаимная потенциальная энергия, так как, для того чтобы раздвинуть молекулы на большие расстояния, нужно затратить работу на преодоление сил притяжения молекул друг к другу. Кроме того, совершается работа против внешнего давления, ибо пар занимает больший объем, чем жидкость, из которой он образовался. При испарении 1 кг воды при 100°С расходуется 2250 кДж (удельная теплота парообразования). Из них 170 кДж затрачивается на работу против внешнего давления, остаток, равный 2250—170=2080 кДж, представляет собой приращение внутренней энергии 1 кг пара по сравнению с энергией 1 кг воды. Как видно, для воды большая часть теплоты при испарении идет на приращение внутренней энергии и лишь небольшая часть тратится на совершение внешней работы.
Обратный испарению процесс конденсации сопровождается выделением тепла. Скрытая теплота конденсации, разумеется, равна скрытой теплоте испарения, количество теплоты, выделяемое паром при ее конденсации Qk=-rm,
Влажность. Измерение влажности воздуха. Так как в воздухе всегда присутствует какое-то количество водяных паров, то полное атмосферное давление складывается из давление сухого воздуха и давления водяных паров. Количество водяного пара в воздухе можно выразить при помощи следующих величин:
а) давление водяного пара (парциальное - давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре);
б) абсолютная влажность воздуха — масса водяного пара в 1 м3 воздуха, выраженная в граммах;
в) относительная влажность -отношение давления водяных паров в воздухе к давлению насыщенных паров при той же температуре. Относительная влажность влияет как на самочувствие человека, так и на качество выпускаемой или хранящейся в этих условиях продукции.
Для определения влажности воздуха пользуются гигрометром и психрометром. Наиболее простым прибором для измерения влажности воздуха является волосяной гигрометр, конструкция которого изображена на рис.2.11. В качестве детали, чувствительной к изменению влажности, служит обезжиренный человеческий волос 1. Он закреплен в верхней части прибора 2, обернут вокруг ролика 3 и натянут при помощи специально подобранного груза 4. К ролику прикреплена стрелка 5. При увеличении относительной влажности воздуха волос удлиняется и вызывает вращение ролика вместе со стрелкой. Передвигаясь по шкале, она и указывает значение влажности воздуха, выраженное в процентах. Если одновременно измерять и температуру воздуха, то можно определить абсолютную влажность воздуха и давление водяного пара.
 Психрометр
изображен на рис. 2.12. Прибор состоит из
двух одинаковых термометров. Резервуар
одного из термометров обернут куском
чистого батиста, нижний край которого
опущен в небольшой стеклянный стаканчик
с дистиллированной водой. Вода смачивает
батист и испаряется на шарике термометра,
если водяной пар в воздухе не является
насыщенным. Вследствие потери тепла на
испарение шарик термометра охлаждается,
и смоченный термометр показывает меньшую
температуру, чем сухой. Разница между
показаниями термометров тем больше,
чем больше отличается давление водяного
пара, содержащегося в воздухе, от давления
насыщенного пара. По показаниям сухого
и смоченного термометров при помощи
особых психрометрических таблиц находят
давление водяного пара и относительную
влажность воздуха.
Психрометр
изображен на рис. 2.12. Прибор состоит из
двух одинаковых термометров. Резервуар
одного из термометров обернут куском
чистого батиста, нижний край которого
опущен в небольшой стеклянный стаканчик
с дистиллированной водой. Вода смачивает
батист и испаряется на шарике термометра,
если водяной пар в воздухе не является
насыщенным. Вследствие потери тепла на
испарение шарик термометра охлаждается,
и смоченный термометр показывает меньшую
температуру, чем сухой. Разница между
показаниями термометров тем больше,
чем больше отличается давление водяного
пара, содержащегося в воздухе, от давления
насыщенного пара. По показаниям сухого
и смоченного термометров при помощи
особых психрометрических таблиц находят
давление водяного пара и относительную
влажность воздуха.
При понижении температуры воздуха при постоянной массе водяного пара относительная влажность возрастает, так как чем ниже температура воздуха, тем ближе водяной пар к состоянию насыщения. Наконец, при какой-то определенной температуре относительная влажность становится равной 100 %, и дальнейшее понижение температуры приводит к конденсации водяного пара. Появляется туман, «запотевают» окна, на траве оседают капельки росы. Температуру, при которой пар при данном давлении становится насыщенным, или, что то же самое, при которой относительная влажность воздуха становится равной 100 %, называют точкой росы. Точку росы легко определить, медленно охлаждая металлический стакан, например бросая в него кусочки льда, и замечая температуру, при которой стакан запотевает. Существуют и специальные приборы для определения точки росы, действующие примерно по тому же способу. Зная точку росы, можно определить давление водяных паров и влажность воздуха абсолютную и относительную.

Превращение жидкости в твердое тело (затвердевание или кристаллизация) является примером другого фазового перехода. Этот переход происходит при определенной температуре (температуре затвердевания) и сопровождается выделением тепла (теплоты затвердевания). Наоборот, при плавлении твердого тела (переходе его в жидкое состояние) необходима затрата некоторого количества тепла (теплота плавления). Очевидно, теплота плавления должна быть равна теплоте затвердевания.
Аналогично
формулируются понятия «скрытая и
удельная теплота плавления»: ![]() - удельная теплота плавления.
- удельная теплота плавления.![]() .
Qпл.=λm
- количество теплоты, необходимое для
плавления тела; Qкр.=-λm
-количество теплоты, выделяемое при
кристаллизации тела.
.
Qпл.=λm
- количество теплоты, необходимое для
плавления тела; Qкр.=-λm
-количество теплоты, выделяемое при
кристаллизации тела.
Диаграмма состояний. Испарение происходит не только в поверхности жидкости. Твердое тело также испаряется. Процесс испарения твердого тела называется сублимацией или возгонкой. Испаряющиеся молекулы твердого тела образуют над его поверхностью пар так же, как это происходит при испарении жидкости. При определенных давлении и температуре пар и твердое тело могут находиться в равновесии. Это насыщенный пар. Упругость насыщенного пара, как и в случае жидкости, зависит от температуры, увеличиваясь при повышении и уменьшаясь при ее понижении. Давление насыщенного пара твердых тел при обычных температурах очень мало. Хорошо испаряющимся твердым телом является лед. Таким образом, кроме фазового перехода жидкость-газ возможны фазовые переходы твердое тело – жидкость и твердое тело – газ. При описании состояния вещества и его фазовых переходов обычно используются переменные р и Т, в которых изображаются кривые равновесия при фазовых переходах данного вещества. Диаграмма, построенная в этих переменных, называется диаграммой состояния. Каждой точке на этой диаграмме соответствует определенное равновесное состояние. Она позволяет определить, какие фазовые переходы происходят при тех или иных процессах.
Рассмотрим
случай термодинамической системы, в
которой в равновесии находятся сразу
три фазы однородного по физико-химическим
свойствам вещества (например: лед, вода
и пар). Равновесие такой системы будет
наблюдаться при одновременном выполнении
трех условий, соответствующих равновесию
этих фаз между собой.Решение этой системы
уравнений при условии отсутствия
химических превращений дает совершенно
определенные значения давления ртр
и температуры Ттр,
при которых три фазы могут существовать
одновременно. Точка на диаграмме
состояния в переменных р
и Т
(см. рис.2.13), соответствующая указанным
значениям давления и температуры, называется тройной
точкой.
и температуры, называется тройной
точкой.
В этой точке встречаются кривая плавления, разделяющая твердую и жидкую фазы, кривая испарения, разделяющая жидкую и газообразную фазы, и кривая возгонки, разделяющая твердую и газообразную фазы. Тройная точка – точка на диаграмме состояния в переменных р и Т, соответствующая равновесному состоянию всех трех фаз – твердого, жидкого и пара.
Вещество в трех различных агрегатных состояниях может наблюдаться и при значениях температуры и давления, не соответствующих тройной точке. Например, в природе при различных погодных условиях наблюдаются одновременно лед, вода и водяной пар (последний, как правило, косвенным образом). Однако, в отличие от состояния в тройной точке, указанные состояния не являются равновесными, и для них характерен постоянный переход вещества из одной фазы в другую.
Значения давления и температуры в тройной точке для различных веществ очень стабильны, что позволяет использовать тройную точку для калибровки различных температурных шкал. Тройная точка воды используется в качестве основной реперной точки для температурных шкал Кельвина и Цельсия. Тройная точка воды - реперная точка (0,0100 0С), при которой достигается равновесие между тремя фазами воды (твердой, жидкой и газообразной), может быть реализована с весьма высокой точностью. К тому же она не зависит от барометрического давления.
Прибор, в котором реализуется тройная точка воды, позволяет получить воспроизводимось температуры, характеризующуюся погрешностью менее 0,0001К.
М етастабильные
состояния. Критические состояния.
Реальный
газ описывается уравнением Ван-дер-Ваальса
етастабильные
состояния. Критические состояния.
Реальный
газ описывается уравнением Ван-дер-Ваальса
 (для одного моля). Постоянные а
и b
зависят от рода газа, от сил взаимодействия
между его молекулами. В соответствии с
уравнением идеального газа его изотермы
являются гиперболами, т.е. отражают
обратно пропорциональную зависимость
давления от объема объему при постоянной
температуре. Кривая зависимости Р=f(V)
для реального газа отличается от
гиперболы. На графике 2.14 приведены
реальные изотермы для различных
температур. Чем ниже изотерма (ниже
температура), тем больше она отличается
от изотермы идеального газа. Изотерма,
для которой разница в объемах газообразной
и жидкой фазах равна нулю, называется
критической, она имеет точку перегиба
К.
Не заштрихованная область относится
к газообразному состоянию вещества.
Область, отмеченная пунктиром, - к
состоянию вещества в двух фазах -
газообразной и жидкой. Заштрихованная
область - к жидкой фазе. Этой точке
соответствуют определенный объем,
называемый критическим VK
и определенное давление PK,
также называемое критическим. При
определенном сочетании значений давления
и температуры исчезает различие в
свойствах жидкой и газообразной фаз
вещества. При температуре, равной
критической температуре Tкр
для данного вещества, плотности пара и
жидкости становятся одинаковыми. И при
температуре выше критической никаким
увеличением давления нельзя перевести
газ в жидкость. Для каждого вещества
критическая температура имеет вполне
определенное значение. Для воды
критическая температура равна 647,3 К,
При температуре 374 °C (647 K) и давлении
22,064 MПa (218 атм) вода проходит критическую
точку и не может оставаться в жидком
состоянии.
(для одного моля). Постоянные а
и b
зависят от рода газа, от сил взаимодействия
между его молекулами. В соответствии с
уравнением идеального газа его изотермы
являются гиперболами, т.е. отражают
обратно пропорциональную зависимость
давления от объема объему при постоянной
температуре. Кривая зависимости Р=f(V)
для реального газа отличается от
гиперболы. На графике 2.14 приведены
реальные изотермы для различных
температур. Чем ниже изотерма (ниже
температура), тем больше она отличается
от изотермы идеального газа. Изотерма,
для которой разница в объемах газообразной
и жидкой фазах равна нулю, называется
критической, она имеет точку перегиба
К.
Не заштрихованная область относится
к газообразному состоянию вещества.
Область, отмеченная пунктиром, - к
состоянию вещества в двух фазах -
газообразной и жидкой. Заштрихованная
область - к жидкой фазе. Этой точке
соответствуют определенный объем,
называемый критическим VK
и определенное давление PK,
также называемое критическим. При
определенном сочетании значений давления
и температуры исчезает различие в
свойствах жидкой и газообразной фаз
вещества. При температуре, равной
критической температуре Tкр
для данного вещества, плотности пара и
жидкости становятся одинаковыми. И при
температуре выше критической никаким
увеличением давления нельзя перевести
газ в жидкость. Для каждого вещества
критическая температура имеет вполне
определенное значение. Для воды
критическая температура равна 647,3 К,
При температуре 374 °C (647 K) и давлении
22,064 MПa (218 атм) вода проходит критическую
точку и не может оставаться в жидком
состоянии.
Для каждого вещества его TK, VK и PK имеют определенные значения. Для большинства веществ они измерены и указаны в справочниках по физике. Азот, кислород, воздух, водород, гелий - имеют низкие критические температуры.
Н а
диаграмме состояний в координатах P-V
горизонтальные участки изотерм
соответствуют термодинамическому
переходу жидкость-пар. При особых
условиях могут быть реализованы
состояния, изображаемые пунктирными
линиями на рис.2.15.
а
диаграмме состояний в координатах P-V
горизонтальные участки изотерм
соответствуют термодинамическому
переходу жидкость-пар. При особых
условиях могут быть реализованы
состояния, изображаемые пунктирными
линиями на рис.2.15.

Эти состояния называются метастабильными. то есть такие состояния, при которых одна фаза существует в области температур и давлений другой фазы. Справа - переохлажденный пар, слева - перегретая жидкость.
Такие же метастабильные состояния существуют и для фазовых переходов из одного агрегатного состояния в другое вблизи тройной точки Эти состояния будут возникать в том случае, если зародыши другой фазы (капли и пузырьки соответственно) отсутствуют или у них имеется тенденция к исчезновению. Так как образованию зародышей способствуют всякого рода примеси и неоднородности, то метастабильные состояния свойственны хорошо очищенным веществам. Опыты показали, что если в паре содержатся частицы пыли, то даже при небольшом пересыщении образуется туман и происходит переход из точки А в точку В (см. рис. 2.15).
Применение метастабильных состояний в физических измерениях.
Если в пересыщенном паре образовались зародыши новой фазы (например, крупные капельки жидкости), то при определенных условиях, когда равновесное давление пара над поверхностью капельки меньше давления окружающего пересыщенного пара, пар конденсируется. Конденсации пересыщенного пара способствует и наличие пыли или других мелких частиц. Эффективными центрами конденсации оказываются электрически заряженные частицы или ионы. Этот эффект лежит в основе действия одного из основных приборов ядерной физики и физики элементарных частиц – камеры Вильсона. Принцип действия камеры изображен на рис.2.16.

Камера Вильсона представляет собой герметически замкнутый объем, заполненный каким-либо неконденсирующимся газом (гелий, аргон и пр.) и насыщенными парами некоторых жидкостей -вода, этиловый спирт и пр. Одна из стенок камеры делается подвижной (в виде поршня или упругой диафрагмы). При адиабатическом расширении температура смеси, заполняющей камеру, понижается. При этом пар становится пересыщенным, но без центров конденсации конденсироваться не будет. Если, однако, через пространство камеры пролетит заряженная частица, она оставит за собой цепочку ионов. На этих ионах, как на зародышах, сразу начинается конденсация пересыщенного пара в виде маленьких капелек, достигающих видимых размеров. Так возникают треки – цепочки капелек, расположенных вдоль траектории ионизующей частицы, которые можно осветить и сфотографировать. После этого камера Вильсона возвращается в исходное состояние, то есть процесс ее работы является циклическим. Количество циклов достигает обычно от 1 до 6 в минуту. Небольшая скорость работы в какой-то степени является недостатком камеры Вильсона, Другим недостатком камеры Вильсона является то, что у нее небольшой объем рабочей камеры (диаметр ее, как правило, составляет несколько десятков сантиметров). Это не позволяет достаточно полно исследовать треки частиц с высокой энергией. Камеру Вильсона часто размещают в магнитном поле.
Другим прибором, использующим другое метастабильное состояние – перегретую жидкость является пузырьковая камера. прибор для регистрации следов (или треков) быстрых заряженных частиц, действие которого основано на вскипании перегретой жидкости вдоль траектории частицы. Камера заполнена жидкостью, которая находится в состоянии близком к вскипанию. При резком уменьшении давления жидкость становится перегретой. Если в данном состоянии в камеру попадёт ионизирующая частица, то её траектория будет отмечена цепочкой пузырьков пара и может быть сфотографирована. Пузырьковые камеры (кроме ксеноновых) размещаются в сильных магнитных полях. Это позволяет определить импульсы заряженных частиц по измерению радиусов кривизны их траекторий. Частицы впускаются в камеру в момент её максимальной чувствительности. Спустя некоторое время, необходимое для достижения пузырьками достаточно больших размеров, камера освещается, и следы фотографируются (с помощью 2—4 объективов делается стереосъемка). После фотографирования давление поднимается до прежней величины, пузырьки исчезают, и камера снова оказывается готовой к действию. Весь цикл работы составляет величину менее 1 сек, время чувствительности ~ 10—40 мсек. Эффективность регистрации пузырьковой камеры различных процессов взаимодействия или распада определяется в основном её размерами. Наиболее типичный объём — сотни литров, но существуют камеры гораздо большего размера, например водородная камера «Мирабель» на ускорителе Института физики высоких энергий РАН имеет объём 10 м³; водородная камера на ускорителе Национальной ускорительной лаборатории США — объём 25 м³.
Тепловые характеристики вещества.. Все макроскопические тела обладают энергией, заключенной внутри самих тел. Внутренняя энергия тела - энергия движения и взаимодействия частиц, из которых состоит тело. Внутренняя энергия тела не зависит от положения тела относительно других тел и от скорости движения тела. Она слагается: - из энергии хаотического движения молекул; - из потенциальной энергии атомов, образующих молекулу или кристаллическую структуру; - из внутриатомной энергии и т.д. Внутренняя энергия тела может проявляться в форме теплоты или в форме работы, совершаемой телом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Молекулярно-кинетическая
теория приводит к следующему выражению
для внутренней энергии одного моля
идеального одноатомного газа (гелий,
неон и др.), молекулы которого совершают
только поступательное движение: 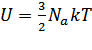 .
Для реального газа, состоящего из
молекул, движение молекул не исчерпывается
поступательным движением молекул,
молекулы могут вращаться, атомы, из
которых состоят молекулы, могут
колебаться. На эти виды движения также
расходуется энергия.
.
Для реального газа, состоящего из
молекул, движение молекул не исчерпывается
поступательным движением молекул,
молекулы могут вращаться, атомы, из
которых состоят молекулы, могут
колебаться. На эти виды движения также
расходуется энергия.
Для каждой микрочастицы вводится число степеней свободы - число независимых переменных (координат), полностью определяющих положение объекта в пространстве. В ряде задач молекулу одноатомного газа рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения (i =3). При этом энергию вращательного движения можно не учитывать.
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью. Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i = 5). Трехатомная и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Энергию связи атомов в молекуле условно можно представить в виде пружинок (рис.2.17). Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 от среднего значения энергии молекулы Е=1/2 кТ.
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2. , а на каждую колебательную степень свободы - в среднем энергия, равная kT. При расчете энергии многоатомных молекул с колебательными степенями свободы необходимо, кроме кинетической энергии атомов в молекуле, учитывать потенциальную энергию взаимодействия этих атомов. Если для описания колебаний атомов в молекуле применима модель гармонического осциллятора, что, как показывает опыт, оправдано, то среднюю потенциальную энергию атомов можно считать равной их средней кинетической энергии. Тогда полную энергию, приходящуюся на одну колебательную степень свободы, можно считать равной удвоенной её кинетической энергии. Поэтому при учете колебательных степеней свободы необходимо энергию молекулы увеличивать на величину кТ, (а число i соответственно на два) на каждую колебательную степень свободы. Этим отличается учет колебательных степеней свободы от учета степеней свободы, связанных с поступательным и вращательным движением, где на каждую степень свободы приходится энергия, равная кТ/2. Колебательная степень обладает вдвое большей энергией потому, что при увеличении температуры возрастает не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы Е=i/2kT;.где i - сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы: i = iпост + iвращ + 2 iколеб..Для одноатомного газа Eкин=3/2кТ, на одну степень свободы приходится ½ кТ.
Теплота
– это вид энергии, связанный с внутренней
энергией молекул вещества. Процесс
передачи энергии от одного тела к другому
без совершения работы называют
теплообменом или теплопередачей.
Теплоемкость - свойство материала при
нагревании поглощать теплоту, а при
охлаждении - отдавать ее. У различных
веществ эти свойства отличаются.
Показателем теплоемкости служит удельная
теплоемкость – количество тепла, которое
надо сообщить единице массы (1кг) для
увеличения температуры на 1К.  , где
с
– удельная теплоемкость, m
–
масса вещества, Q
– количество теплоты, необходимое для
повышения температуры на величину ∆T.
, где
с
– удельная теплоемкость, m
–
масса вещества, Q
– количество теплоты, необходимое для
повышения температуры на величину ∆T.
Единицей
СИ для удельной теплоёмкости является
Джоуль на килограмм Кельвин (Дж/(кг К)).
Обычно обозначают буквой С.
Количество теплоты, полученное или
отданное телом ![]() .
Наряду с удельной используют понятие
молярной теплоемкости – количество
тепла, которое надо сообщить одному
молю для повышения температуры на 1К.
.
Наряду с удельной используют понятие
молярной теплоемкости – количество
тепла, которое надо сообщить одному
молю для повышения температуры на 1К.
При
нагревании газа подводимая тепловая
энергия идет на увеличение энергии
молекул. Т.к. средняя энергия молекулы
Е=i/2kT,
где i- количество степеней свободы
молекул, то С=NkTi/2T=Nki/2.
Молярная теплоемкость С=Nаki/2=Ri/2.
Для одноатомного газа молярная
теплоемкость  ,
т.к. молекулы обладают тремя поступательными
степенями свободы. Для водорода, молекулы
которого обладают тремя поступательными,
двумя вращательными и одной колебательной
степенями свободы
,
т.к. молекулы обладают тремя поступательными
степенями свободы. Для водорода, молекулы
которого обладают тремя поступательными,
двумя вращательными и одной колебательной
степенями свободы  .
.
Количество
теплоты, поглощённой телом при изменении
его состояния, зависит не только от
начального и конечного, но и от способа,
которым был осуществлен процесс перехода
между ними. Соответственно от способа
нагревания тела зависит и его теплоемкость.
Обычно различают теплоемкость при
постоянном объёме (Cv)
и при постоянном давлении (Ср),
если в процессе нагревания поддерживаются
постоянными соответственно его объём
или давление. При нагревании при
постоянном давлении часть теплоты идёт
на производство работы расширения тела,
а часть — на увеличение его внутренней
энергии,
тогда как при нагревании при постоянном
объёме вся теплота расходуется только
на увеличение внутренней энергии; в
связи с этим ![]() .
.
С классической точки зрения теплоемкость не зависит от температуры, но практически это не так. Это противоречие устраняется квантовой физикой, которая утверждает, что энергия поглощается объектами порциями (квантами) и при низких температурах возбуждаются не все степени движений.
Если
среде имеют место различные значения
температуры, т. е. имеется градиент
температуры, то в этой среде будет
существовать тепловой поток (распространение
теплоты). Тепловой поток направлен в
сторону убывания температуры. Удельный
тепловой поток (или интенсивность
теплового потока) прямо пропорционален
градиенту температуры:
 , где
, где
![]() —
коэффициент пропорциональности; n
—
нормаль к изотермической поверхности.
—
коэффициент пропорциональности; n
—
нормаль к изотермической поверхности.
Коэффициент
пропорциональности ![]() называют коэффициентом
теплопроводности.
Он является физическим параметром
вещества и зависит от его структуры,
плотности, влажности, температуры и
давления. Коэффициент теплопроводности
определяется опытным путем. Для получения
положительного значения теплового
потока в уравнении необходимо ставить
знак минус. Зная удельный тепловой
поток, можем определить тепловой поток,
проходящий через некоторую площадь F,
выделенную на изотермической поверхности:
Q=qF=
называют коэффициентом
теплопроводности.
Он является физическим параметром
вещества и зависит от его структуры,
плотности, влажности, температуры и
давления. Коэффициент теплопроводности
определяется опытным путем. Для получения
положительного значения теплового
потока в уравнении необходимо ставить
знак минус. Зная удельный тепловой
поток, можем определить тепловой поток,
проходящий через некоторую площадь F,
выделенную на изотермической поверхности:
Q=qF= .
.
Теплопроводность вещества, в частности воды и льда, имеет исключительное значение в природе. Благодаря теплопроводности (передаче теплоты) происходит выравнивание температуры в теле или среде. В твердых телах передача теплоты (теплопередача) осуществляется от молекулы к молекуле вследствие их соприкосновения. Для твердых тел она является единственно возможной и называют ее кондукцией, касанием или молекулярной. В жидких средах молекулярная теплопередача играет существенную роль только в том случае, если жидкость находится в покое. Для жидкостей, в том числе и для воды, характерно существование еще двух видов теплопередачи, обусловленных турбулентностью потока и конвекцией.
Численно коэффициент теплопроводности равен количеству теплоты, которая проходит через 1 м2 изотермической поверхности в 1 ч при слое вещества в 1 м и разности температуры на границах слоя в 1°С.
Коэффициент
теплопроводности твердых тел составляет
от 0.005 (газы) до 400 ![]() (металлы).
(металлы).
Коэффициент теплопроводности большинства жидкостей с повышением температуры убывает. Вода в этом отношении является исключением. Она имеет максимум теплопроводности при температуре 127°С.
Давление оказывает влияние на теплопроводность жидкости, однако, в большей степени на теплопроводность газов. У воды теплопроводность при изменении давления в больших пределах практически не меняется. Это связано с малой сжимаемостью воды, которая определяется характером сил межмолекулярного взаимодействия.
В жидкостях и газах теплота передается также путем перемещения частиц, носителей тепловой энергии. Такой способ называется конвективным теплопереносом.
