
- •Введение
- •1. Теоретические основы
- •1.1. Адсорбция. Теория адсорбции ленгмюра. Уравнение фрейндлиха
- •1.2. Поверхностное натяжение чистых жидкостей и растворов. Уравнение гиббса
- •1.3. Суспензии, их свойства. Седиментационный анализ суспензий
- •1.4. Методы получения дисперсных систем. Коагуляция коллоидных растворов
- •2. Экспериментальная часть
- •2.1. Изучение адсорбции уксусной кислоты углем и определение констант уравнения ленгмюра
- •Обработка экспериментальных данных
- •Техника безопасности
- •Контрольные вопросы
- •2.2. Измерение поверхностного натяжения и вычисление адсорбции поверхностно – активного вещества
- •Порядок проведение эксперимента
- •Обработка экспериментальных данных
- •Техника безопасности
- •Контрольные вопросы
- •2.3. Седиментационный анализ суспензий
- •Порядок проведение эксперимента
- •Обработка экспериментальных данных
- •Определение порога коагуляции золя гидрата окиси железа солями кс1 и к2s04
- •Взаимная коагуляция золей берлинской лазури и гидрата окиси железа
- •3. Построение касательной к кривой в данной точке при графическом дифференцировании
- •Техника безопасности
- •Контрольные вопросы
- •Список литературы
- •Содержание
- •Редактор л.А. Маркешина
- •450062, Г. Уфа, ул. Космонавтов,1.
Уфимский государственный нефтяной технический
университет
Салаватский филиал
Кафедра химико-технологических процессов
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ
Учебно-методическое пособие к лабораторным работам для
студентов специальности 25.04
УФА 2002
Учебно-методическое пособие предназначено для студентов дневного и вечернего отделений специальности 25.04 для выполнения лабораторных работ по дисциплине «Поверхностные явления и дисперсные системы». Целью лабораторных работ является закрепление знаний студентов, полученных при изучении теоретической части курса. В сборнике дана теоретическая часть и методика проведения лабораторных работ по темам: «Адсорбция», «Поверхностное натяжение», «Седиментация» и «Коагуляция».
Составители: Ситдикова А.В., ассистент
Михольсакя И.Н., доц., канд. биол. наук
Рецензент Евдокимова Н.Г., доц., канд., техн. наук
© Уфимский государственный нефтяной технический университет, 2002
Введение
Физическая химия дисперсных систем и поверхностных явлений, называемая в силу традиции и краткости коллоидной химией, - одна из важнейших и самостоятельных физико-химических дисциплин. Представление о коллоидах как об особой группе веществ вошло в науку в середине XIX в.; растворы этих веществ отличались от обычных рядом признаков, в частности тем, что растворенное вещество не проходило через мембраны с очень тонкими порами и не обнаруживало заметной диффузии.
В начале XX в. было установлено, что любое вещество может быть получено в виде коллоида и, следовательно, нужно говорить не о коллоидных веществах, а о коллоидном состоянии как о всеобщем особом состоянии материи.
Коллоидное состояние характеризуется определенной дисперсностью (раздробленностью) вещества. Поскольку раздробленное вещество находиться всегда в какой-либо среде, с которой оно в большей или меньшей степени взаимодействует, свойства его нельзя рассматривать в отрыве от этой среды. Следовательно, коллоидные или дисперсные системы состоят из двух (или более) фаз: дисперсной фазы (одной или нескольких) – совокупности частиц или пор – и дисперсионной среды, т.е. являются гетерогенными. Таким образом, коллоиды – это гетерогенные системы, содержащие вещества в высокодисперсном состоянии.
Дисперсными системами является большинство окружающих нас реальных тел: почва, тела растительного и животного мира, облака и туманы, многие продукты промышленных производств, в том числе строительные материалы, металлы, полимеры, бумага, кожа, ткани и продукты питания.
Таким образом, коллоидная химия изучает наиболее распространенное в природе состояние тел – дисперсное состояние и его превращения. Универсальность дисперсного состояния реальных тел определяет фундаментальный и общенаучный характер коллоидной химии.
1. Теоретические основы
1.1. Адсорбция. Теория адсорбции ленгмюра. Уравнение фрейндлиха
Адсорбция - это концентрирование вещества из объема фаз на поверхности их раздела, например, газа или растворенного вещества на поверхности твердого тела или жидкости. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объемной фазы вещество называется адсорбатом.
В зависимости от агрегатного состояния смежных фаз различают адсорбцию газов на твердых адсорбентах; адсорбцию растворенных веществ на границе твердое тело - жидкость и на границе раздела раствор - газ.
Адсорбция количественно характеризуется двумя величинами:
1) количеством или массой адсорбата, т.e. числом молей или граммов, приходящихся на единицу площади поверхности или на единицу массы адсорбента;
2) избытком вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же объеме фазы, так же отнесенным к единице площади поверхности или единице массы адсорбентa.
График зависимости количества адсорбированного вещества от равновесного давления или равновесной концентрации при постоянной температуре называется изотермой адсорбции.
Согласно теории адсорбции Ленгмюра:
1) адсорбция происходит на активных центрах адсорбента, каждый из которых способен удерживать только одну молекулу адсорбата;
2) поверхность адсорбента покрывается лишь одним слоем молекул адсорбата, т.е. адсорбция является мономолекулярной;
3) отсутствует взаимодействие между адсорбированными молекулами адсорбата;
4) поверхность адсорбента является однородной;
5) процесс адсорбции является обратимым, наряду с адсорбцией идет обратный процесс - десорбция.
Ленгмюр ( в 1915 году ) вывел уравнение изотермы адсорбции
![]() ,
(1)
,
(1)
где С - равновесная концентрация адсорбата в объёме; В - адсорбционный коэффициент, зависящий от природы адсорбента и адсорбата, от температуры; Гmax - предельная адсорбция.
При
низких концентрациях и слабой адсорбции
![]() <<1,
значением этого произведения в знаменателе
уравнения
(1)
можно пренебречь. При этом уравнение
(1)
переходит в (2)
<<1,
значением этого произведения в знаменателе
уравнения
(1)
можно пренебречь. При этом уравнение
(1)
переходит в (2)
Г=Гmax.![]() (2)
(2)
Таким
образом, при малых концентрациях
количество адсорбированного вещества
прямо пропорционально равновесной
концентрации адсорбата. При высоких
концентрациях адсорбата и сильной
адсорбции
![]() 1.
Пренебрегая единицей в знаменателе
уравнения (1),
получим
1.
Пренебрегая единицей в знаменателе
уравнения (1),
получим
Г=Гmax , (3)
т.e. адсорбция достигает предельного значения и не зависит от равновесной концентрации адсорбата (рисунок 1).

Рисунок 1 - Изотерма адсорбции Ленгмюра
Для адсорбции из газовой фазы в уравнении (1) концентрацию адсорбата следует заменить его равновесным парциальным давлением (Р):
![]() (4)
(4)
Уравнение (1) можно преобразовать:
![]() (5)
(5)
Уравнение (5) является уравнением прямой в координатах С и С/Г (рисунок 2).
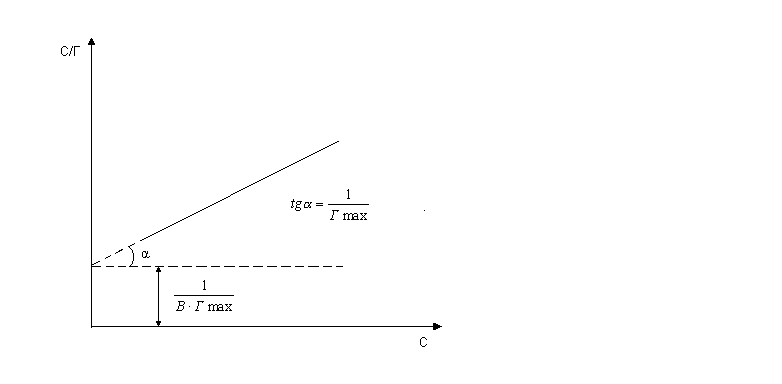
Рисунок 2 - Зависимость С/Г от С
Тангенс угла наклона прямой к оси абсцисс даёт численное значение 1/Гmax, а отрезок, отсекаемый этой прямой на оси ординат, выражает величину 1/(В.Гmax).
Во многих случаях экспериментальные данные по адсорбции вещества на твёрдой поверхности удовлетворительно описываются эмпирическим уравнением фрейндлиха
Г=К.С1/n, (6)
которое для адсорбции из газовой фазы принимает вид
Г=К Р,1|n (7)
где К и n- константы, зависящие от природы адсорбента и адсорбата, температуры.
Логарифмируя уравнение (6), получим
![]() (8)
(8)
В координатах lgС и lgГ уравнение (8) представляет прямую линию (рисунок 3).
Тангенс угла наклона прямой к оси абсцисс равен 1/n, отрезок, отсекаемый прямой на оси ординат, равен lgК. ( tgα=1/n, |ОА|=lgK).
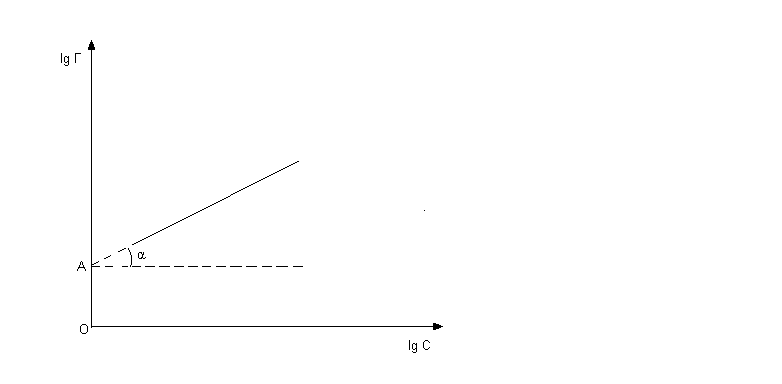
Рисунок 3 - Зависимость lgГ от lgС
