
- •Метод молекулярных орбиталей.
- •Орбитали двухатомной молекулы.
- •Межмолекулярные силы. Силы, обеспечивающие ионную и ковалентную связи, называются химическими. Эти силы убывают с возрастанием расстояния между атомами.
- •Спектры молекул.
- •Итак, полная энергия молекулы определяется выражением
- •Комбинационное рассеяние света.
Метод молекулярных орбиталей.
Рассмотрим молекулу водорода с точки зрения метода молекулярных орбиталей.
Существуют
![]() -орбитали,
-орбитали,
![]() -
орбитали,
-
орбитали,
![]() -орбитали
и т.д. Для водородоподобных атомов:
-орбитали
и т.д. Для водородоподобных атомов:
![]() -орбиталь
– это волновая функция
-орбиталь
– это волновая функция
![]() ,
,
![]() -орбиталь
-
-орбиталь
-
![]() ,
,
![]() -орбиталь
-
-орбиталь
-
![]() и т.д.,
и т.д.,
![]() -орбиталь
-
-орбиталь
-
![]() ;
;
![]()
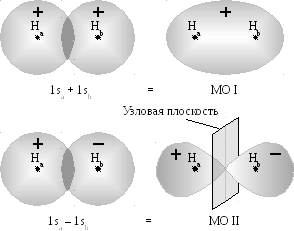 -орбиталь
– это комбинация функций
-орбиталь
– это комбинация функций
![]() - это атомные орбитали.
- это атомные орбитали.
При сближении двух
атомов водорода, находящихся в
невозбужденном состоянии,
![]() -орбитали
начинают проникать друг в друга.
-орбитали
начинают проникать друг в друга.
Возможны 2 варианта:
1. Если спины электронов антипараллельны, то волновые функции атомов перекрывают друг друга - положительное перекрывание атомных орбиталей - образовании связывающей молекулярной орбитали.
Энергия связывающей
орбитали ниже исходных уровней энергии
![]() -атомных
орбиталей
-атомных
орбиталей
В соответствии с
принципом минимума энергии в молекуле
![]() в основном состоянии связывающая
молекулярная орбиталь заселена двумя
электронами.
в основном состоянии связывающая
молекулярная орбиталь заселена двумя
электронами.
Э нергия
связи молекулы
нергия
связи молекулы
![]() равна удвоенной разности энергий атомной
орбитали
равна удвоенной разности энергий атомной
орбитали
![]() и связывающей молекулярной орбитали.
и связывающей молекулярной орбитали.
2. Если спины электронов сближающихся атомов водорода параллельны, то волновые функции атомов не перекрываются
Энергия соответствующей
молекулярной орбитали, называемой
разрыхляющей (антисвязывающей), лежит
выше энергии
![]() -
атомной орбитали на столько же, на
сколько ниже ее находится связывающая
молекулярная орбиталь
-
атомной орбитали на столько же, на
сколько ниже ее находится связывающая
молекулярная орбиталь
На двух молекулярных орбиталях может находиться от нуля до четырех электронов.
Один электрон на
связывающей орбитали соответствует
молекулярному иону
![]() .
.
Ион
![]() имеет 3 электрона и в соответствии с
принципом Паули третий электрон должен
размещаться на разрыхляющей орбитали.
имеет 3 электрона и в соответствии с
принципом Паули третий электрон должен
размещаться на разрыхляющей орбитали.
Разность между
числом электронных пар на связывающих
и антисвязывающих орбиталях, приходящаяся
на одну связь, называется порядком (или
кратностью) связи и является мерой
прочности связи. Для молекулы
![]() порядок связи равен 1. Экспериментально
определенная энергия связи для этой
молекулы составляет 436 кДж/моль.
Молекулярные ионы
порядок связи равен 1. Экспериментально
определенная энергия связи для этой
молекулы составляет 436 кДж/моль.
Молекулярные ионы
![]() и
и
![]() имеют порядок связи ½ и их энергии связи
соответственно равны 265 и 17 кДж/моль.
имеют порядок связи ½ и их энергии связи
соответственно равны 265 и 17 кДж/моль.
Связывающие и
антисвязывающие орбитали, образованные
![]() -
и
-
и
![]() -электронами.
-электронами.
М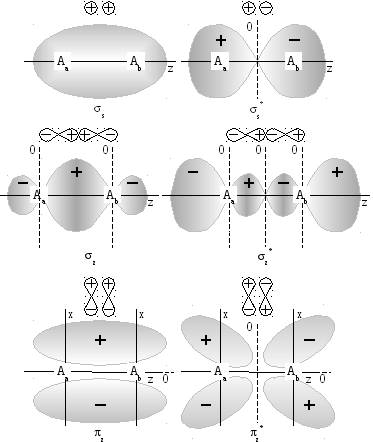 инимальная
энергия молекулы достигается лишь при
определенном перекрытии атомных
орбиталей.
инимальная
энергия молекулы достигается лишь при
определенном перекрытии атомных
орбиталей.
Если АО
перекрываются только одним лепестком,
то говорят, что в молекуле осуществляется
![]() -связь.
Связывающие (
-связь.
Связывающие (![]() )
и антисвязывающие (разрыхляющие) (
)
и антисвязывающие (разрыхляющие) (![]() )
молекулярные орбитали, образованные
)
молекулярные орбитали, образованные
![]() -электронами
обладают аксиальной симметрией.
-электронами
обладают аксиальной симметрией.
Если АО
перекрываются двумя лепестками волновой
функции говорят об образовании
![]() -связи.
-связи.![]() -
и
-
и
![]() -атомные
орбитали образуют как
-атомные
орбитали образуют как
![]() ,
так и
,
так и
![]() -молекулярные
орбитали, совпадающие сами с собой при
вращении вокруг оси связи на
-молекулярные
орбитали, совпадающие сами с собой при
вращении вокруг оси связи на
![]() .
.
Орбитали двухатомной молекулы.
-
Гомоядерные молекулы соответствуют второму ряду таблицы Менделеева:
 .
Следует заметить, что при образовании
молекул перекрытие нижних слоев не
дает молекулярной связи.
.
Следует заметить, что при образовании
молекул перекрытие нижних слоев не
дает молекулярной связи.
-
Гетероядерные молекулы.
Молекула фторводорода
![]() - простейший случай гетероядерной
молекулы.
- простейший случай гетероядерной
молекулы.
Э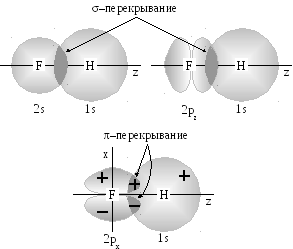 лектроотрицательность
(т.е. мера притяжения электронов, которую
проявляет атом, участвующий в ковалентной
связи)
лектроотрицательность
(т.е. мера притяжения электронов, которую
проявляет атом, участвующий в ковалентной
связи)
![]() равна 2,1, а
равна 2,1, а
![]() - 4,1.
- 4,1.
В молекуле
![]() атом
атом
![]() притягивает электроны значительно
сильнее, чем атом
притягивает электроны значительно
сильнее, чем атом
![]() и связанные электроны уже не симметрично
распределены между атомами, а смещены
к атому фтора.
и связанные электроны уже не симметрично
распределены между атомами, а смещены
к атому фтора.
Э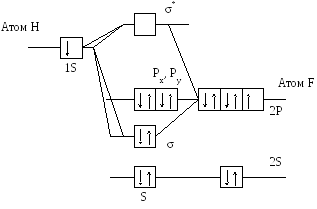 лектронная
конфигурация атома водорода -
лектронная
конфигурация атома водорода -
![]() ,
атома фтора -
,
атома фтора -![]() ,
следовательно перекрытие с водородом
идет по одной
,
следовательно перекрытие с водородом
идет по одной
![]() -орбитали:
-орбитали:
![]() -взаимодействие
-взаимодействие
![]() -
и
-
и
![]() -орбиталей.
Две другие орбитали фтора (
-орбиталей.
Две другие орбитали фтора (![]() и
и
![]() )
ориентированы перпендикулярно к оси
связи и могут образовывать только
)
ориентированы перпендикулярно к оси
связи и могут образовывать только
![]() -связи
, для которых у водорода нет подходящих
орбиталей. В результате мы получаем
схему,
-связи
, для которых у водорода нет подходящих
орбиталей. В результате мы получаем
схему,
где
![]() и
и
![]() - связывающая и разрыхляющая
(антисвязывающая) молекулярные орбитали
и не измененные орбитали фтора -
- связывающая и разрыхляющая
(антисвязывающая) молекулярные орбитали
и не измененные орбитали фтора -
![]() ,
,
![]() и
и
![]() - несвязывающие орбитали.
- несвязывающие орбитали.
Связывающие
![]() - орбитали заселены двумя электронами,
и эти электроны имеют большую вероятность
пребывания у атома
- орбитали заселены двумя электронами,
и эти электроны имеют большую вероятность
пребывания у атома
![]() ,
чем у атома
,
чем у атома
![]() .
Это означает, что связывающая орбиталь
должна более походить на атомную
.
Это означает, что связывающая орбиталь
должна более походить на атомную
![]() -орбиталь
-орбиталь
![]() ,
чем на
,
чем на
![]() -орбиталь
-орбиталь
![]() ,
т.е. вклад первой из них в молекулярную
,
т.е. вклад первой из них в молекулярную
![]() -орбиталь
должен быть больше, чем второй. Поэтому
атом
-орбиталь
должен быть больше, чем второй. Поэтому
атом
![]() несет на себе некоторый отрицательный
заряд, а атом
несет на себе некоторый отрицательный
заряд, а атом
![]() - такой же по величине положительный
заряд и молекула фторводорода представляет
собой диполь
- такой же по величине положительный
заряд и молекула фторводорода представляет
собой диполь
![]() ,
где
,
где
![]() ,
,
![]() - это степень ионности.
- это степень ионности.
Если
![]() ,
то имеем ионную связь, которая является
предельным случаем ковалентной связи.
,
то имеем ионную связь, которая является
предельным случаем ковалентной связи.
Если
![]() молекула будет симметричной и это
соответствует предельному случаю чисто
ковалентной связи.
молекула будет симметричной и это
соответствует предельному случаю чисто
ковалентной связи.
Все гетероядерные молекулы обладают дипольным моментом, который может быть измерен экспериментально.
