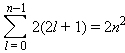- •Зв'язок з хімічним потенціалом
- •Білет 2 питання1
- •Зв'язок з хімічним потенціалом
- •2)Розчини електролітів та неелектролітів. Дисоціація. Водневий показник
- •3)Подвійний електричний шар
- •1)Гази , рідини, тверді тіла. Гомогенні та гетерогенні системи. Поверхні поділу фаз. Поверхневі явища. Поверхневий натяг.
- •2)Дисперсні системи. Класифікація. Ступінь дисперсності. Колоїдні системи(розчини). Нанофізика, нанохімія, нанотехнології.
- •3)Ентропія та ентальпія. Вільна енергія Гіббса.
- •Визначення
- •Історична довідка
- •3. Хімічна кінетика. Молекулярність і порядок реакції. Визначення порядку реакції.
- •1.Предмет фіз.-хімії.Коротка історична довідка. Інтегрування різних наукових напрямів.
- •2.Дисперсні системи.Класифікація.Ступінь дисперсності.Колоїдні системи(розчини) .Нанофізика. Нанохімія. Нанотехнології.
- •3.Поверхневіявища.Пар.Міцели.Адсорбція.Адсорбціяелектролітів.Змочування.Аднезія. Когезія.
- •Швидкості та константи швидкості. Хімічна кінетика. Закон дії мас. Порядок реакції. Молекулярність. Каталітичні реакції. Фотохімічні реакції.
- •Асоціація молекул у гомогенних полярних та слабкополярних рідинах. Структурування дисперсних систем. Залежність в’язкості від температури. Залежність деформацій від тиску.
- •1)Ідеальні гази та ідеальні розчини.Концентрація та активність.Тиск і фугітивність. Електроліти і неелектроліти. Дисоціація (електролітична).Ph.Вода.Йонний добуток води.Жорсткість(твердість води).Dh.
- •3)Загальний аналіз процесів у друкарських та після друкарських операціях виготовлення друкових видань та пакувань.
- •Закон Ньютона. Рідини, що підпорядковуються цьому закону(ньютонівські рідини) та ті, що не підпорядковуються йому (неньютонівські рідини).
- •Хімічна кінетика. Молекулярність і порядок реації. Визначення порядку реакції.
- •1.Властивості атомів, молекул, йонів та агрегатні стани. Гази, рідини, тверді тіла.Гомогенні та гетерогенні системи.Поверхні поділу фаз.
- •2.Дисперсні системи класифікація.Ступінь дисперсності. Колоїдні системи (розчини).Нанофізика, нанахімія, нанотехнології.
- •3.Поверхневі явища. Пар.Міцели. Адсорбція. Адсорбція електронів. Адгезія.Когезія.Принцип друкарського офсетного процесу.
- •1.Періодична система елементів.Хімічні перетворення – зміна електричних систем молекул (атомів йонів). Хімічні зв’язки. Молекули…Спектри поглинання та випромінювання.
- •2.Закон н. Рідини, що підпорядковуються закону н. Та ті, що не підпорядковуються йому.Поведінка фабри у друкарському процесі.
- •3.Хімічна кінетика. Молекулярність та порядок реакції.Визначення порядку реакції.Швидкості технологічних процесів. Обладнання та матеріали.
Білет 1
|
Білет 1 питання1 Атом - мікрочастинка, яка складається з ядра, що вміщує протони і нейтрони, і електронів, які утворюють зовнішню оболонку
|
|
Квантові числа - параметри, що визначають електронну структуру і властивості електронів атома n - головне квантове число; визначає енергетичний рівень і енергію електрона n = 1, 2, ...[1]... ; l - орбітальне квантове число; визначає енергетичний підрівень, форму орбіталі і енергію електрона l = 0, 1, ...[1]... n-1; ml - магнітне квантове число; визначає просторову орієнтацію атомних орбіталей ml = -1... [1]...+1; ms - спінове квантове число; визначає власний механічний і магнітний момент електрона ms = -1/2 або +1/2 Кількість енергетичних підрівнів на енергетичному рівні дорівнює n Кількість орбіталей на енергетичному підрівні дорівнює 2l + 1 Електронна ємність енергетичного підрівня дорівнює 2·(2l + 1) |
|
Принцип Паулі - в атомі не може бути двох або більше електронів з однаковим набором всіх чотирьох квантових чисел Правило Гунда - сумарне спінове число електронів на даному підрівні повинне бути максимальним Правило Клечковського - енергетичні підрівні заповнюються у порядку зростання величиниn+l, а при рівних значеннях - у порядку зростання величини n. |
А́томною орбіта́ллю у хімії називають базисну хвильову функцію електрона в атомі.
Електронні орбіталі класифікують за орбітальними квантовими числами.
l =0. Такі орбіталі називаються s-орбіталями. Вони сферично симетричні.
![]() ,
,
де Yl,m — відповідні сферичні гармоніки, а f(r) — радіальна хвильова функція, яка залежить від інших квантових чисел і яка розраховується при розв'язанні стаціонарного рівняння Шредінгера.
l
= 1. Такі орбіталі називаються p-орбіталями й
мають витягнутий гантелеподібний
вигляд. Існує три (2l+1)
p-орбіталі,
направлені вздовж трьох осей координат.
Їх
позначають ![]() ,
, ![]() ,
, ![]() .
Три p-орбіталі відрізняються магнітним
квантовим числом m.
.
Три p-орбіталі відрізняються магнітним
квантовим числом m.
l
= 2. Такі орбіталі називаються d-орбіталями.
Існує п'ять d-орбіталей, які
позначаються ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
l = 3 відповідає семи f-орбіталям.
Молекулярна орбіталь — наближена хвильова функція електронів молекули, утворена суперпозицією атомних орбіталей різних атомів.
Електронний стан, який описується молекулярною орбіталлю, делокалізований у межах усієї молекули.Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда.
|
|
Принцип наименьшей энергии требует, чтобы электроны заселяли в порядке увеличения энергии элекронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2l + 1 орбитали, на которых размещаются не более 2(2l + 1) электронов. Отсюда следует, что емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов. ФормулА Бора–Бьюри, определяет общее число электронов на уровне с заданным n:
|
|
|
|
Орбитали
с одинаковыми энергиями (вырожденные)
заполняются в соответствии с правилом Гунда:
наименьшей энергией обладает электронная
конфигурация с максимальным спином.
Это означает, что если на p-орбитали три
электрона, то они располагаются так: ![]()
![]()
![]() ,
и суммарный спин S = 3/2, а не
так:
,
и суммарный спин S = 3/2, а не
так: ![]()
![]()
![]() , S = 1/2.
, S = 1/2.
Білет 1 питання3
Ентроп́ія S — в термодинаміці міра енергії у термодинамічній системі, яка не може бути використана для виконання роботи. Вона також є мірою безладдя, присутнього в системі.
Рудольф
Клаузіус визначив зміну ентропії
термодинамічної системи при оборотному
процесі як відношення загальної кількості
теплоти ΔQ,
отриманої або втраченої системою, до
величини абсолютної температури T:![]() Зв'язок між теплоємністю та
ентропією
дається
формуою
Зв'язок між теплоємністю та
ентропією
дається
формуою![]() Згідно
з
визначенням
Больцмана,
ентропія
є
функцією
стану.
Більш
того,
оскільки
(Ω)
може
бути
тільки
натуральним
числом
(1,2,3.), ентропія
повинна
бути
додатньою —
виходячи
з
властивостей логарифма
Ентропія
є
екстенсивною
величиною(залежить
від
маси
і
об'єму
системи),
тому
сумарна
ентропія
двох
систем
S = S1 + S2
Згідно
з
визначенням
Больцмана,
ентропія
є
функцією
стану.
Більш
того,
оскільки
(Ω)
може
бути
тільки
натуральним
числом
(1,2,3.), ентропія
повинна
бути
додатньою —
виходячи
з
властивостей логарифма
Ентропія
є
екстенсивною
величиною(залежить
від
маси
і
об'єму
системи),
тому
сумарна
ентропія
двох
систем
S = S1 + S2
Ентальпі́я (або теплова
функція,
від грец.
«нагріваю») — термодинамічний
потенціал, що характеризує стан
термодинамічної системи при виборі як
основних незалежних змінних ентропії (S)
і тиску (P).
Ентальпія — адитивна функція, тобто
ентальпія всієї системи дорівнює сумі
ентальпій її складових частин. Із
внутрішньою енергією E системи ентальпія
зв'язана співвідношенням:
![]() ,
Ентальпія залежить від тиску
й ентропії системи,
тобто при незмінних N і xi її
повний диференціал дорівнює:
,
Ентальпія залежить від тиску
й ентропії системи,
тобто при незмінних N і xi її
повний диференціал дорівнює:
![]() .
Ентальпія використовується для
опису ізобарних
процесів, тобто процесів, які
відбуваються при сталому тиску. Якщо
процес проходить при сталому тиску, то
приріст ентальпії дорівнює переданій
тілу теплоті dQ = TdS. Тож,
.
Ентальпія використовується для
опису ізобарних
процесів, тобто процесів, які
відбуваються при сталому тиску. Якщо
процес проходить при сталому тиску, то
приріст ентальпії дорівнює переданій
тілу теплоті dQ = TdS. Тож,
![]() ,
,
![]() .
.
Вільна
енергія Гіббса (або потенціал
Гіббса,)-
це термодинамічний
потенціал такого
вигляду:
![]() Енергію Гіббса можна розуміти як
повну хімічну
енергію системи (кристала, рідини
і т.п.)
Енергію Гіббса можна розуміти як
повну хімічну
енергію системи (кристала, рідини
і т.п.)
Класичним
визначенням енергії Гіббса є вираз
![]()
Диференціал енергії
Гіббса для системи з постійним числом
частинок, виражений у власних змінних
- через тиск p
і температуру T:![]()
Для
системи із змінним числом частинок цей
диференціал записується так:
![]()
Тут μ - хімічний потенціал, який можна визначити як енергію, яку необхідно затратити, щоб додати в систему ще одну частку.
Зв'язок з хімічним потенціалом
Використовуючи
властивості екстенсивності термодинамічних
потенціалів, математичним наслідком
яких є співвідношення
Гіббса-Дюгема, можна
показати, що хімічний потенціал є
відношенням енергії Гіббса до числа
частинок в системі:
![]()
Енергія Гіббса і напрям ходу реакції
У
хімічних процесах одночасно діють два
протилежні фактори - ентропійний (TΔS)
і ентальпійний (ΔH).
Сумарний ефект цих протилежних факторів
у процесах, що перебігають при постійному
тиску і температурі, визначає зміна енергії
Гіббса (G):
![]()
З
цього виразу випливає, що ![]() ,
тобто деяка кількість
теплоти витрачається
на збільшенні ентропії (TΔS), ця
частина енергії втрачена для здійснення
корисної роботи,
її часто називають зв'язаною
енергією. Інша частина
теплоти (ΔG) може бути використана
для здійснення роботи, тому енергію
Гіббса часто називають також вільною
енергією.
,
тобто деяка кількість
теплоти витрачається
на збільшенні ентропії (TΔS), ця
частина енергії втрачена для здійснення
корисної роботи,
її часто називають зв'язаною
енергією. Інша частина
теплоти (ΔG) може бути використана
для здійснення роботи, тому енергію
Гіббса часто називають також вільною
енергією.
Білет 1 питання 2
Електролітична дисоціація — явище розпаду нейтральних молекул на іони, що відбувається в електролітах. Наприклад, молекула солі NaCl розпадається при розчиненні на іони Na+ таCl-.
pH, Водневий показник — величина, що показує міру активності іонів водню (Н+) в розчині, тобто ступінь кислотності або лужності цього розчину. Для розведених розчинів можна користуватись терміном «концентрація» замість «активність» у цьому визначенні.
У водних розчинах активність іонів водню визначається константою дисоціації води (Kw=1.011 × 10−14 при 25 °C) та взаємодією з іншими іонами в розчині. Водні розчини із значенням рН, меншим ніж 7, вважаються кислотними, із значенням рН більшим 7 — лужними.
Формула
для обчислення величини рН (що не має
одиниць розмірності) є наступною:
![]()
рН абсолютно чистої води мусить мати значення 7. Але в реальності такого майже ніколи не трапляється — наприклад завдяки тому, що, при розчинюванні у воді вуглекислого газу (СО2) з повітря, утворюється вугільна кислота Н2СО3, яка при дисоціації на іони Н+ та СО32- може зменшувати значення рН води до величини 5.7-6.
Розрахунок для розчинів
Значення pH для слабких та сильних кислот можна розрахувати, використовуючи деякі припущення.
Процес розчинення сильної кислоти, наприклад соляної, у воді можна записати, як: HCl(aq) → H+ + Cl−
Тобто приймаєтся, що в 0.01 M розчині HCl концентрація іонів гідроксонію також становить 0.01 M. Отже: pH = −log10 [H+]:
pH = −log (0.01) що дорівнює 2.
Раствори електролитів, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Р-орбитель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Растворы электролитов обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные св-ва бесконечно разбавленных растворов электролитов , существенно отличаются от тех же св-в растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич.давления в сравнении со значением, предсказываемым законом Вант-Гоффа понижение давления пара р-рителя над р-ром в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация растворов электролитов, особенности теоретич. подходов в сравнении с др. классами р-ров. Неводные растворы электролитов служат средой для проведения синтеза и электрохим. процессов, используются в совр. технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения в-в и др.).
Неелектроліт - речовина, яка не піддається дисоціації на іони, в силу чого її водний розчин не може проводити електричний струм; прикладом неелектроліту може служити водний розчин цукру. Неелектроліти – речовини з ковалентним неполярним зв'язком.
Білет 2