
- •1. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •2. Гетерогенный катализ: основные стадии, энергетический профиль
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Фотохимические реакции. Примеры. Законы фотохимии. Квантовый выход.
- •1. Исходные постулаты термодинамики. Термические и калорические уравнения состояния
- •2. Основные приближенные методы химической кинетики: квазиравновесное и квазистационарное приближения. Условия применимости, энергетические кривые.
- •1. Коллигативные свойства растворов (электролиты и неэлектролиты)
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики
- •1. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье
- •2. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости
- •1. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •2. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •1. Электродвижущая сила (эдс), ее связь с термодинамическими величинами. Типы электрохимических ячеек.
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации.
- •1. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •2. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •1. Третий закон термодинамики. Абсолютная энтропия.
- •2. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •1. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •1. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для обратимых реакций первого порядка.
- •1. Обратимые реакции:
- •2. Параллельные реакции:
- •3. Последовательные реакции:
- •1. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для параллельных реакций первого порядка. Термодинамический и кинетический контроль.
- •1. Обратимые реакции:
- •2. Параллельные реакции
- •1. Вычисление абсолютной энтропии из экспериментальных данных.
- •2. Гетерогенные системы. Фазовый состав. Условия фазового равновесия. Правило фаз Гиббса.
- •1. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •2. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •1. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
- •2. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •1. Объединение 1-ого и 2-ого законов. Фундаментальные уравнения Гиббса для закрытых и открытых систем. Энергии Гельмгольца и Гиббса. Термодинамические потенциалы.
- •2. Осмос. Осмотическое давление. Уравнение Вант-Гоффа и область его применимости
- •1. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора
- •2. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа
- •1. Энтальпия и 1-й закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость
- •2. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Эдс и ее связь с термодинамическими функциями.
- •1. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях
- •2. Простейшая схема ферментативного катализа и ее кинетический анализ. Формула Михаэлиса-Ментен
- •1. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса
- •2. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними
- •1. Зависимость энтальпии и энтропии индивидуального вещества от температуры и давления
- •2. Связь кинетических и термодинамических величин на примере обратимых элементарных реакции 1-го порядка
- •1. Уравнения изотермы, изохоры и изобары реакции
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации
- •1. Уравнения Гиббса-Гельмгольца. Соотношения Максвелла. Связь калорического и термического уравнения состояния
- •2. Растворы. Способы выражения химического состава и связь между ними
- •1. Закон Гесса. Энтальпия образования. Термохимические циклы. Энтальпия химической связи.
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики: закон действующих масс, принцип независимости химических реакций, принцип лимитирующей стадии
- •1. Связь константы равновесия с изменением стандартных термодинамических величин в реакции. Закон действующих масс для гетерогенных реакций и реакций в растворах
- •2. Коллигативные свойства растворов. Осмос. Формула Вант-Гоффа. Криоскопия и эбуллиоскопия
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Дисперсные системы и их классификация. Поверхностное натяжение и его проявление. Смачивание. Поверхностно-активные вещества и механизм его действия
- •1. Количество вещества как внешний параметр открытой системы. Диффузионный контакт между системами. Химический потенциал.
- •2. Зависимость константы равновесия от температуры и давления
- •1. Фундаментальное уравнение Гиббса в переменных p и t. Критерии самопроизвольности процесса и равновесия
- •2. Изотерма, изобара и изостера адсорбции. Уравнение Ленгмюра. Простейшие модельные представления в теории адсорбции.
1. Третий закон термодинамики. Абсолютная энтропия.
Понятие энтропии было введено Клаузиусом. Неравенство Клаузиуса связывает изменение энтропии с количеством теплоты δQ, которым система обменивается с окружением при температуре Т:
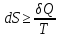
где знак равенства имеет место при обратимых, неравенства – при необратимых процессах.
Абсолютное значение энтропии, полученное при интегрировании, известно с точностью до постоянной интегрирования:

значение этой постоянной устанавливается 3-м законом термодинамики: При нулевой абсолютной температуре энтропия любых веществ, находящихся в равновесном состоянии, имеет одно и то же значение, не зависящее от фазового состояние вещества. В изотермических процессах, происходящих при Т=0, энтропия не зависит ни от обобщенных сил, ни от обобщенных координат.
Т.
К. при 0 К энтропия всех веществ одинакова,
то конкретное значение
 несущественно и его можно принять равным
нулю (постулат Планка): При абсолютном
нуле все идеальные кристаллы имеют
одинаковую энтропию, равную нулю.
несущественно и его можно принять равным
нулю (постулат Планка): При абсолютном
нуле все идеальные кристаллы имеют
одинаковую энтропию, равную нулю.
2. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
Скорость большинства реакций увеличивается с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа заключается в том, что при нагревании на 10 °С скорость большинства химических реакций увеличивается в 2 ÷ 4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:

где γ – температурный коэффициент скорости (γ = 2 ÷ 4).
Правило Вант-Гоффа довольно грубо описывает экспериментальные данные и применимо только в очень ограниченном интервале температур.
Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:

Это уравнение содержит два параметра, характеризующих химическую реакцию: A – предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA – энергия активации, которую можно охарактеризовать как некоторую пороговую энергию, характеризующую высоту энергетического барьера на пути реакции. Энергия активации также не зависит от температуры.
Экспоненциальный множитель в уравнении Аррениуса можно интерпретировать, как долю молекул, энергия которых превышает EA при температуре T.
Аррениус предположил, что в реакцию вступают не все молекулы, а только активные (A*), причем между активными и обычными молекулами существует равновесие, а продукты образуются из активных молекул необратимо:
A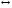 A* → продукты.
A* → продукты.
Активные
молекулы образуются из обычных при
поглощении энергии
 .
Константа скорости превращения активных
молекул в продукты (обозначим ее k2),
по Аррениусу, не зависит от температуры.
Роль температуры, таким образом, сводится
только к сдвигу равновесия A
.
Константа скорости превращения активных
молекул в продукты (обозначим ее k2),
по Аррениусу, не зависит от температуры.
Роль температуры, таким образом, сводится
только к сдвигу равновесия A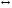 A*
в ту или иную сторону.
A*
в ту или иную сторону.
Скорость
реакции определяется концентрацией
активных молекул:

В условиях равновесия между A и A* эту концентрацию можно выразить через константу равновесия:

Эффективная
константа скорости k в кинетическом
уравнении r = k [A] равна:
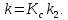
С учетом того, что k2 – величина постоянная, температурная зависимость константы скорости определяется уравнением изохоры Вант-Гоффа для константы равновесия:

Где
 – тепловой эффект реакции активации A
→ A* при постоянном объеме,
который и называют энергией активации.
Интегрируя и обозначая
– тепловой эффект реакции активации A
→ A* при постоянном объеме,
который и называют энергией активации.
Интегрируя и обозначая
 ,
получаем уравнение Аррениуса.
,
получаем уравнение Аррениуса.
Уравнение Аррениуса содержит всего два индивидуальных параметра. Для более точного описания экспериментальных данных еще в 19-м веке было предложено трехпараметрическое уравнение:

Для реакций, у которых предэкспоненциальный множитель слабо зависит от температуры, определяют эффективную, или опытную энергию активации:

Билет 10
