
- •1. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •2. Гетерогенный катализ: основные стадии, энергетический профиль
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Фотохимические реакции. Примеры. Законы фотохимии. Квантовый выход.
- •1. Исходные постулаты термодинамики. Термические и калорические уравнения состояния
- •2. Основные приближенные методы химической кинетики: квазиравновесное и квазистационарное приближения. Условия применимости, энергетические кривые.
- •1. Коллигативные свойства растворов (электролиты и неэлектролиты)
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики
- •1. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье
- •2. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости
- •1. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •2. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •1. Электродвижущая сила (эдс), ее связь с термодинамическими величинами. Типы электрохимических ячеек.
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации.
- •1. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •2. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •1. Третий закон термодинамики. Абсолютная энтропия.
- •2. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •1. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •1. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для обратимых реакций первого порядка.
- •1. Обратимые реакции:
- •2. Параллельные реакции:
- •3. Последовательные реакции:
- •1. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для параллельных реакций первого порядка. Термодинамический и кинетический контроль.
- •1. Обратимые реакции:
- •2. Параллельные реакции
- •1. Вычисление абсолютной энтропии из экспериментальных данных.
- •2. Гетерогенные системы. Фазовый состав. Условия фазового равновесия. Правило фаз Гиббса.
- •1. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •2. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •1. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
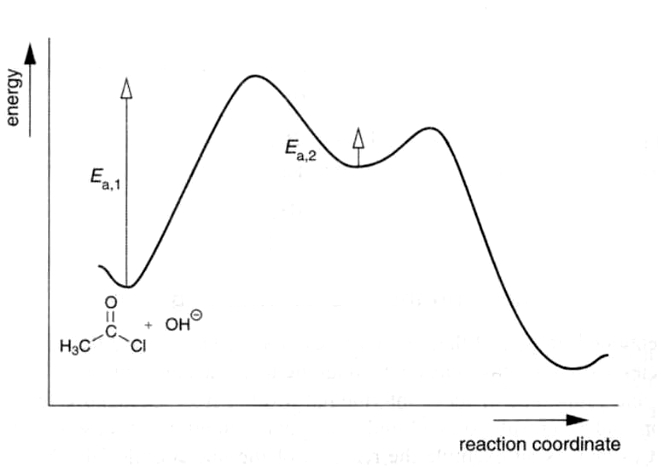
- •2. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •1. Объединение 1-ого и 2-ого законов. Фундаментальные уравнения Гиббса для закрытых и открытых систем. Энергии Гельмгольца и Гиббса. Термодинамические потенциалы.
- •2. Осмос. Осмотическое давление. Уравнение Вант-Гоффа и область его применимости
- •1. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора
- •2. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа
- •1. Энтальпия и 1-й закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость
- •2. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Эдс и ее связь с термодинамическими функциями.
- •1. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях
- •2. Простейшая схема ферментативного катализа и ее кинетический анализ. Формула Михаэлиса-Ментен
- •1. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса
- •2. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними
- •1. Зависимость энтальпии и энтропии индивидуального вещества от температуры и давления
- •2. Связь кинетических и термодинамических величин на примере обратимых элементарных реакции 1-го порядка
- •1. Уравнения изотермы, изохоры и изобары реакции
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации
- •1. Уравнения Гиббса-Гельмгольца. Соотношения Максвелла. Связь калорического и термического уравнения состояния
- •2. Растворы. Способы выражения химического состава и связь между ними
- •1. Закон Гесса. Энтальпия образования. Термохимические циклы. Энтальпия химической связи.
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики: закон действующих масс, принцип независимости химических реакций, принцип лимитирующей стадии
- •1. Связь константы равновесия с изменением стандартных термодинамических величин в реакции. Закон действующих масс для гетерогенных реакций и реакций в растворах
- •2. Коллигативные свойства растворов. Осмос. Формула Вант-Гоффа. Криоскопия и эбуллиоскопия
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Дисперсные системы и их классификация. Поверхностное натяжение и его проявление. Смачивание. Поверхностно-активные вещества и механизм его действия
- •1. Количество вещества как внешний параметр открытой системы. Диффузионный контакт между системами. Химический потенциал.
- •2. Зависимость константы равновесия от температуры и давления
- •1. Фундаментальное уравнение Гиббса в переменных p и t. Критерии самопроизвольности процесса и равновесия
- •2. Изотерма, изобара и изостера адсорбции. Уравнение Ленгмюра. Простейшие модельные представления в теории адсорбции.
1. Исходные постулаты термодинамики. Термические и калорические уравнения состояния
Существует несколько способов аксиоматического построения термодинамики. Можно исходить из того, что выводы и соотношения термодинамики можно сформулировать на основе двух постулатов и трех законов.
Первый постулат, или основной постулат термодинамики:
Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти.
Это положение ограничивает размер систем, которые описывает термодинамика. Оно не выполняется для систем астрономических масштабов (наличие дальнодействующих гравитационных сил) и микроскопических систем с малым числом частиц (флуктуации).
Самопроизвольный переход системы из неравновесного состояния в равновесное называют релаксацией. Основной постулат термодинамики ничего не говорит о времени релаксации, он утверждает, что равновесное состояние системы будет обязательно достигнуто, но длительность такого процесса никак не определена. В классической равновесной термодинамике вообще нет понятия времени.
Второй постулат, или нулевой закон термодинамики:
Если система А находится в тепловом равновесии с системой В, а та находится в равновесии с системой С, то системы А и С также находятся в тепловом равновесии.
Второй постулат говорит о существовании особой интенсивной переменной, характеризующей состояние теплового равновесия и называемой температурой. Системы, находящиеся в тепловом равновесии, имеют одинаковую температуру. Т. о. нулевой закон – постулат о существовании температуры.
Из
постулатов термодинамики следует, что
при равновесии внутренние переменные
термодинамической системы являются
функциями внешних переменных и
температуры. Отсюда следует вывод о
существовании уравнения состояния
термодинамической системы, связывающего
внутренние переменные с внешними
переменными и температурой или внутренней
энергией. В общем случае уравнение
состояния имеет вид:
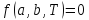 ,
или
,
или
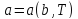 ,
где a – совокупность
внутренних параметров, b
– внешних параметров.
,
где a – совокупность
внутренних параметров, b
– внешних параметров.
Внутренний
параметр – давление, внешний – объем,
термическое уравнение состояния -
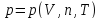
Внутренний
параметр – энергия, внешний – объем,
калорическое уравнение состояния
-
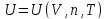
Количество независимых уравнений состояния равняется вариантности системы (числу независимых переменных, достаточных для описания термодинамического состояния равновесной системы (на единицу больше числа внешних переменных))
Если известны термическое и калорическое уравнения состояния, то аппарат термодинамики позволяет определить все термодинамические свойства системы, т. е. получить ее полное термодинамическое описание. Сами уравнения состояния нельзя вывести методами классической термодинамики, но их можно определить экспериментально.
2. Основные приближенные методы химической кинетики: квазиравновесное и квазистационарное приближения. Условия применимости, энергетические кривые.
Для большинства сложных реакций, включающих несколько элементарных стадий, кинетические уравнения обычно настолько сложны, что их можно решить только численным интегрированием. В то же время, разные константы скорости, входящие в эти уравнения обычно отличаются друг от друга на много порядков, что позволяет при решении кинетических уравнений использовать приближенные методы.
Рассмотрим
последовательность реакций первого
порядка:
 ,
для которой
,
для которой
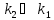 .
Учитывая соотношение между константами
скорости, точное решение системы
кинетических уравнений можно привести
к упрощенному виду:
.
Учитывая соотношение между константами
скорости, точное решение системы
кинетических уравнений можно привести
к упрощенному виду:

Из
этого приближенного решения следую два
важных вывода. Во-первых, зависимость
от времени всех веществ определяется
только одной константой скорости
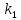 .
Это означает, что кинетика всего процесса
определяется скоростью самой медленной
его стадии, которая характеризуется
наименьшей константой скорости.
.
Это означает, что кинетика всего процесса
определяется скоростью самой медленной
его стадии, которая характеризуется
наименьшей константой скорости.
Согласно
приближенному решению при
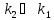 концентрация В в любой момент времени
очень мала, следовательно мала и скорость
ее изменения. В этих условиях концентрацию
промежуточного вещества считают
квазистационарной. Условие
квазистационарности позволяет выражать
концентрацию промежуточных веществ
через концентрации реагентов и тем
самым упрощать кинетические уравнения.
концентрация В в любой момент времени
очень мала, следовательно мала и скорость
ее изменения. В этих условиях концентрацию
промежуточного вещества считают
квазистационарной. Условие
квазистационарности позволяет выражать
концентрацию промежуточных веществ
через концентрации реагентов и тем
самым упрощать кинетические уравнения.
Применяя
квазистационарное приближение для
неустойчивых промежуточных продуктов,
надо иметь в виду два обстоятельства.
Во-первых, скорости образования и
расходования этих продуктов, хоть и
одинаковы, но изменяются со временем.
Во-вторых, если сравнить концентрации
промежуточных веществ и продуктов,
рассчитанные в квазистационарном
приближении, с точными значениям, видно,
что приближение начинает хорошо работать
лишь через небольшое время после начала
реакции (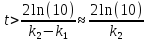 )
)
Приближение
квазистационарных концентраций –
основной метод анализа кинетики и
механизма химических реакций. Помимо
него, используют квазиравновесное
приближение, суть которого можно пояснить
на примере простейшей кинетической
схемы, включающей обратимую стадию: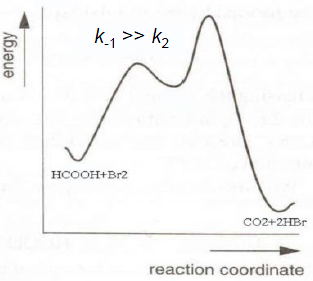
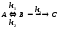 ,
квазиравновесное приближение применяют
в том случае, когда равновесие в обратимой
реакции быстро устанавливается и
медленно разрушается. Для приведенной
выше схемы это означает, что
,
квазиравновесное приближение применяют
в том случае, когда равновесие в обратимой
реакции быстро устанавливается и
медленно разрушается. Для приведенной
выше схемы это означает, что
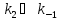 .
Тогда концентрацию промежуточного
продукта В можно выразить через константу
равновесия:
.
Тогда концентрацию промежуточного
продукта В можно выразить через константу
равновесия:
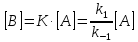 .
Скорость реакции равна
.
Скорость реакции равна
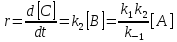
Это уравнение показывает, что суммарная реакция имеет первый порядок по реагенту, причем эффективная константа скорости содержит константы скорости всех элементарных стадий.
Анализ условий применимости рассмотренных приближений показывает, что в некотором смысле они противоположны друг другу: квазистационарное приближение применимо тогда, когда промежуточное вещество распадается быстро, а квазиравновесное – когда оно распадается медленно.
Билет 4
