
- •1. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •2. Гетерогенный катализ: основные стадии, энергетический профиль
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Фотохимические реакции. Примеры. Законы фотохимии. Квантовый выход.
- •1. Исходные постулаты термодинамики. Термические и калорические уравнения состояния
- •2. Основные приближенные методы химической кинетики: квазиравновесное и квазистационарное приближения. Условия применимости, энергетические кривые.
- •1. Коллигативные свойства растворов (электролиты и неэлектролиты)
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики
- •1. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье
- •2. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости
- •1. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •2. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •1. Электродвижущая сила (эдс), ее связь с термодинамическими величинами. Типы электрохимических ячеек.
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации.
- •1. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •2. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •1. Третий закон термодинамики. Абсолютная энтропия.
- •2. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •1. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •1. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для обратимых реакций первого порядка.
- •1. Обратимые реакции:
- •2. Параллельные реакции:
- •3. Последовательные реакции:
- •1. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •2. Сложные химические реакции. Механизмы реакций. Решение кинетических уравнений для параллельных реакций первого порядка. Термодинамический и кинетический контроль.
- •1. Обратимые реакции:
- •2. Параллельные реакции
- •1. Вычисление абсолютной энтропии из экспериментальных данных.
- •2. Гетерогенные системы. Фазовый состав. Условия фазового равновесия. Правило фаз Гиббса.
- •1. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •2. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •1. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
- •2. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •1. Объединение 1-ого и 2-ого законов. Фундаментальные уравнения Гиббса для закрытых и открытых систем. Энергии Гельмгольца и Гиббса. Термодинамические потенциалы.
- •2. Осмос. Осмотическое давление. Уравнение Вант-Гоффа и область его применимости
- •1. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора
- •2. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа
- •1. Энтальпия и 1-й закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость
- •2. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Эдс и ее связь с термодинамическими функциями.
- •1. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях
- •2. Простейшая схема ферментативного катализа и ее кинетический анализ. Формула Михаэлиса-Ментен
- •1. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса
- •2. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними
- •1. Зависимость энтальпии и энтропии индивидуального вещества от температуры и давления
- •2. Связь кинетических и термодинамических величин на примере обратимых элементарных реакции 1-го порядка
- •1. Уравнения изотермы, изохоры и изобары реакции
- •2. Формальная кинетика реакций целого порядка. Период полупревращения, его зависимость от начальной концентрации
- •1. Уравнения Гиббса-Гельмгольца. Соотношения Максвелла. Связь калорического и термического уравнения состояния
- •2. Растворы. Способы выражения химического состава и связь между ними
- •1. Закон Гесса. Энтальпия образования. Термохимические циклы. Энтальпия химической связи.
- •2. Скорость химической реакции. Кинетическое уравнение. Постулаты химической кинетики: закон действующих масс, принцип независимости химических реакций, принцип лимитирующей стадии
- •1. Связь константы равновесия с изменением стандартных термодинамических величин в реакции. Закон действующих масс для гетерогенных реакций и реакций в растворах
- •2. Коллигативные свойства растворов. Осмос. Формула Вант-Гоффа. Криоскопия и эбуллиоскопия
- •1. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определение энтропии, их взаимосвязь.
- •2. Дисперсные системы и их классификация. Поверхностное натяжение и его проявление. Смачивание. Поверхностно-активные вещества и механизм его действия
- •1. Количество вещества как внешний параметр открытой системы. Диффузионный контакт между системами. Химический потенциал.
- •2. Зависимость константы равновесия от температуры и давления
- •1. Фундаментальное уравнение Гиббса в переменных p и t. Критерии самопроизвольности процесса и равновесия
- •2. Изотерма, изобара и изостера адсорбции. Уравнение Ленгмюра. Простейшие модельные представления в теории адсорбции.
Билет 1
1. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
Удобной
системой сравнения свойств раствора
является идеальный раствор, под которым
обычно понимают раствор, для компонент
которого при всех составах и температурах
выполняется закон Рауля: Давление
пара растворителя
 над раствором пропорционально мольной
доле растворителя
над раствором пропорционально мольной
доле растворителя
 в растворе:
в растворе:
 ,
где
,
где
 – давление насыщенного пара компонента
над раствором,
– давление насыщенного пара компонента
над раствором,
 – давление насыщенного пара над чистым
компонентом (s – saturated
— насыщенный),
– давление насыщенного пара над чистым
компонентом (s – saturated
— насыщенный),
 – мольная доля i-го
компонента в растворе.
– мольная доля i-го
компонента в растворе.
Для бинарного раствора з. Рауля:

то
есть относительное понижение давления
пара растворителя над раствором равно
мольной доле
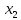 растворенного вещества.
растворенного вещества.
Общее
давление пара над раствором равно сумме
парциальных давлений
 и
и
 :
:

то есть давление пара линейно зависит от состава раствора.
В
реальных предельно разбавленных
растворах для растворителя выполняется
закон Рауля, а для растворенного вещества
– закон Генри:
 ,
где
,
где
 – константа Генри.
– константа Генри.
В
идеальных растворах закон Генри совпадает
с законом Рауля ( ).
В реальных растворах могут наблюдаться
различные отклонения от закона Рауля.
).
В реальных растворах могут наблюдаться
различные отклонения от закона Рауля.
Идеальному поведению соответствуют следующие выражения для химических потенциалов компонентов раствора:
Для
газа:

Для
конденсированных растворов:
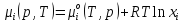
Где
 – хим. потенциал компонента в стандартном
состоянии, p – общее
давление в системе
– хим. потенциал компонента в стандартном
состоянии, p – общее
давление в системе
Мольная энергия Гиббса идеального бинарного раствора:

Признаком идеальности раствора является аддитивность парциальных давлений, парциальных объемов, теплоемкостей и энтальпий компонентов. Тепловой эффект при образовании идеального раствора равен нулю, объем не изменяется, а энтропия равна идеальной энтропии смешения.
Идеальные растворы образуются из веществ с одинаковой плотностью и энергией взаимодействия между частицами.
Идеальные растворы образуются без изменения объема.
2. Гетерогенный катализ: основные стадии, энергетический профиль
Катализ – изменение скорости химической реакции в присутствии катализаторов. Катализ положительный, если скорость реакции увеличивается, и отрицательный, если скорость уменьшается. При гомогенном катализе реагенты и катализатор находятся в одной фазе, при гетерогенном катализе – в разных фазах
Катализатор – вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается. Замедляющий катализатор – ингибитор. Биологические катализаторы белковой природы – ферменты.
В каталитических реакциях, протекающих на поверхности твердого катализатора, можно выделить 5 стадий:
-
Диффузия вещества к поверхности катализатора
-
Обратимая адсорбция вещества
-
Реакция на поверхности, в адсорбционном слое
-
Обратимая десорбция продуктов реакции от поверхности в объем.
//адсорбция – изменение концентрации вещества на границе раздела фаз по сравнению с объемом//
Общая скорость каталитической реакции определяется скоростью самой медленной из этих стадий.
Если
не рассматривать диффузию и считать,
что равновесие адсорбциядесорбция
устанавливается быстро, то скорость
каталитической реакции определяется
скоростью реакции в адсорбционном слое,
где роль реагента играют свободные
адсорбционные центры. Простейший
механизм гетерогенного катализа
описывается схемой:


На
энергетическом профиле реакции,
протекающей на поверхности катализатора,
появляются дополнительные максимуму
и минимумы, связанные с процессами
адсорбции реагентов (14),
десорбции продуктов (56)
и химической реакции в адсорбционном
слое (45). Кажущаяся
энергия активации гетерогенной реакции
 меньше истинной энергии активации в
адсорбционном слое
меньше истинной энергии активации в
адсорбционном слое
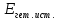 на величину теплового эффекта адсорбции
реагента:
на величину теплового эффекта адсорбции
реагента:

В
общем случае уравнение химической
реакции на поверхности можно записать
следующим образом:

Согласно
закону действующих масс для гетерогенной
реакции, скорость реакции
пропорциональна произведению степеней
заполнения поверхности реагентами и
свободными центрами:
 ,
где степени заполнения
при условии адсорбционного равновесия
определяются по уравнению Ленгмюра
,
где степени заполнения
при условии адсорбционного равновесия
определяются по уравнению Ленгмюра
( ):
):
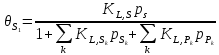

( – константы абсорбционного равновесия,
p – парциальные давления).
Скорость гетерогенной каталитической
реакции определяется давлениями не
только реагентов, но и продуктов реакции.
– константы абсорбционного равновесия,
p – парциальные давления).
Скорость гетерогенной каталитической
реакции определяется давлениями не
только реагентов, но и продуктов реакции.
Билет 2
