
- •Мікрогетерогенні системи, розчинни високомолекулярних сполук. Системи з рідкою дисперсною фазою
- •Практичне значення емульсій і емульгування
- •3.1 Системи з твердим дисперсійним середовищем
- •Напівколоїди і розчини високомолекулярних сполук
- •1. Мила та їх властивості
- •Високомолекулярні сполуки (вмс)
- •Набухання вмс та елементи теорії їх розчинення вмс
- •Розчини високомолекулярних електролітів. Властивості розчинів білків. В'язкість розчинів вмс, залежність в'язкості від рН середовища. Ізоелектричний стан. Характеристика деяких властивостей вмс
- •Поліелектроліти
- •Білки як поліелектроліти
- •Ізоелектрична точка білків
- •Порушення стійкості розчинів вмс. Висолювання, коацервація Коагуляція розчинів високомолекулярних сполук
- •Коацервація
- •Гелі, їх виникнення, будова і властивості
- •Синерезіс гелів
- •Б – розділення гелю на дві фази
- •Тиксотропія
Набухання вмс та елементи теорії їх розчинення вмс
Розчинення ВМС з лінійними молекулами (іноді з розгалуженими), на відміну від низькомолекулярних сполук, відбувається в декілька етапів. Перша стадія - набухання. Цей процес характерний тільки для ВМС і виражається поглинанням низькомолекулярного розчинника, збільшенням маси, зміною механічних властивостей, однак без зміни однорідності.
Причиною набухання є дифузія молекул розчинника в структуру ВМС. Макромолекули цих сполук упаковані відносно нещільно, в них є порожнечі і щілини, в які й проникають молекули розчинника.
Кількісною характеристикою процесу набухання є ступінь набухання, обумовлений співвідношенням:
![]()
![]() (1)
(1)
де w0 і V0 - наважка та об'єм ВМС до набухання відповідно;
w і V— ті самі параметри після набухання.
Як бачимо, ступінь
набухання - це фізична величина, яка
чисельно дорівнює масі розчинника,
поглиненої одиницею маси
ВМС. Визначаючи
![]() у різні проміжки часу, можна одержати
криві
у різні проміжки часу, можна одержати
криві
![]() (
(![]() ),
які ілюструють кінетику процесу
набухання.
),
які ілюструють кінетику процесу
набухання.
Рис.
1. Характерні кінетичні криві процесу
набухання
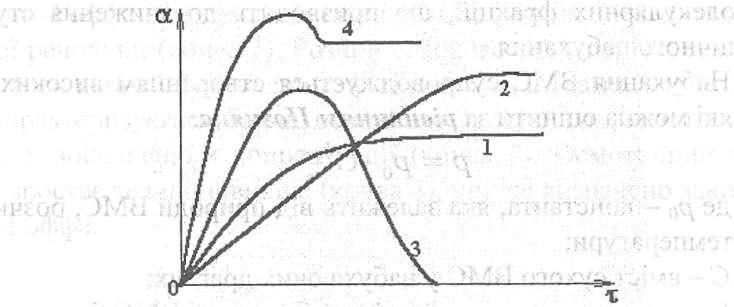
Криві 1 і 2 можна описати диференціальним рівнянням:
![]() (2)
(2)
Розв'язок рівняння цього має вигляд:
![]() (3)
(3)
де
![]() - ступінь граничного набухання
(горизонтальна ділянка на кривих
1 і
2 рис.
2);
- ступінь граничного набухання
(горизонтальна ділянка на кривих
1 і
2 рис.
2);
![]() -
ступінь набухання до моменту часу
-
ступінь набухання до моменту часу
![]() ,
,
К - константа швидкості набухання (залежить від природи ВМС, природи розчинника і температури).
Очевидно, що
швидкість набухання визначається
параметром da/dt,
а здатність ВМС до набухання – параметром
![]() .
.
Зупинимося на
характерних ознаках ВМС, які ілюструються
кінетичними кривими набухання (рис. 2).
Крива 1 відповідає швидкому набуханню,
але з малим значенням
![]() .
Крива 2 характеризує повільне набухання
ВМС, але з високим значенням
.
Крива 2 характеризує повільне набухання
ВМС, але з високим значенням
![]() Крива 3 відповідає необмеженому набуханню,
коли ВМС цілком розчиняється в розчиннику.
У цьому випадку параметр
Крива 3 відповідає необмеженому набуханню,
коли ВМС цілком розчиняється в розчиннику.
У цьому випадку параметр![]() не має фізичного змісту, хоча на кривій
і відзначений максимум. Крива 4
ілюструє випадок обмеженого набухання,
коли на початкових етапах із ВМС
екстрагується значна кількість
низькомолекулярних фракцій, що
призводить до зниження ступеня граничного
набухання.
не має фізичного змісту, хоча на кривій
і відзначений максимум. Крива 4
ілюструє випадок обмеженого набухання,
коли на початкових етапах із ВМС
екстрагується значна кількість
низькомолекулярних фракцій, що
призводить до зниження ступеня граничного
набухання.
Набухання ВМС супроводжується створенням високих тисків, які можна оцінити за рівнянням Позняка:
Р
= Ро![]() Ск
,
(5)
Ск
,
(5)
де р0 - константа, яка залежить від природи ВМС, розчинника і температури;
С - вміст сухого ВМС у набухаючих драглях;
к – константа, значення якої для більшості ВМС близьке до 3.
Очевидно, що при С -1 р = р0.
Набухання ВМС супроводжується також ефектами контракції (зменшення об'єму системи «ВМС - розчинник» на початкових стадіях) і тепловим ефектом набухання.
Набухання необхідно враховувати в процесах переробки і зберігання зерна. Воно використовується у кондитерському виробництві (приготування різних желе), у хлібопекарській промисловості та інших технологічних процесах харчових виробництв.
Розчини високомолекулярних електролітів. Властивості розчинів білків. В'язкість розчинів вмс, залежність в'язкості від рН середовища. Ізоелектричний стан. Характеристика деяких властивостей вмс
Здатність ВМС розчинятися в тому або іншому розчиннику залежить від співвідношення полярностей компонентів системи, фазового стану ВМС, гнучкості макромолекул і густини їх упаковки. Так, неполярні полімери, що мають гнучкі молекули, необмежено розчиняються в неполярних розчинниках (наприклад, натуральний каучук в бензині). Полімери з вираженою полярністю і жорсткими ланцюгами не здатні розчинятися в таких розчинниках (наприклад, клітковина), а в полярних розчинниках набухають обмежено. Аморфні полі-мери розчиняються краще, ніж кристалічні.
На розчинність ВМС робить вплив і упаковка молекул в речовині. Наприклад, сполуки з рихлою упаковкою молекул (багато полістиролів) розчи-няються легше, ніж речовини з щільною упаковкою (наприклад, гума). З підвищенням температури розчинність більшості ВМС зростає. Для сильно полярних ВМС і розчинників процес розчинності оборотний.
З молекулярно-кінетичних властивостей розчинів ВМС найбільш виражені три – дифузія, осмотичний тиск і седіментація. Макромолекули ВМС мають, розміри міцел золей. Вони мають низьку дифузійну здатність. Для визначення коефіцієнта дифузії застосовується метод Ламма. Він заснований на фотографуванні шкали через стовп рідини, де протікає дифузія. Цей метод використовується для визначення молекулярної маси ВМС.
Осмотичний тиск розбавлених розчинів визначається рівнянням Вант-Гоффа
р = (С/т) RТ,
де C – масова концентрація; т – маса 1 молю; R – газова постійна; Т – абсо-лютна температура.
У розчинів ВМС воно вище, ніж за законом Вант-Гоффа. Причина цього – гнучкість молекул полімерів: чим гнучкіша молекула, тим більше відхилення від даного рівняння. Осмотичний тиск розчину ВМС зростає швидше, ніж концентрація. При збільшенні концентрації ВМС збільшується число сегментів, з яких складається його гнучка молекула. Осмотичний тиск розчину сахарози зростає у міру зростання концентрації.
Розчини ВМС седиментаційно стійкі. Це пов'язано з низьким коефіцієнтом дифузії і високим ступенем сольватації, а також з малою густиною розчиненої речовини.
Розчини ВМС відрізняються від ліофобних колоїдних розчинів оптичними властивостями. Так, ланцюгові молекули полімерів не видно під ультрамікроскопом. Розчини ВМС гомогенні, величина їх молекул по довжині наближається до розмірів частинок золю, а по двох параметрах нагадує звичні молекули. Окрім цього, лінійні молекули багатьох ВМС в розчинах неможливо знайти через сильну їхню сольватацію.
Коефіцієнт заломлення розчинів ВМС, як правило, близький до коефіці-єнта заломлення дисперсійного середовища. Розчини ВМС в порівнянні з колоїдними розчинами, розсіюють світло менше. На підставі цього розроблені методи визначення молекулярної маси полімеру по вимірюванню каламутності його розчину при розбавленні. Розчини ВМС вибірково поглинають світло. По інтенсивності поглинання розчинами ультрафіолетових і інфрачервоних спектрів в молекулах полімерів визначають наявність зв'язаних зв'язків і певних атомних груп.
Розчини ВМС – агрегатно стійкі системи. Вони можуть бути розбавленими і концентрованими. Наприклад, концентрація білків в концентрованих розчинах досягає 10-12 %. При введенні в розчини ВМС електролітів (найчастіше нейтральних солей) відбувається їх висолювання. Механізм висолювання відрізняється від механізму коагуляції золю. Коагуляція відбувається при введенні в систему невеликих кількостей електроліту і є необоротнім процесом. При коагуляції відбувається стиснення подвійного електричного шару із зменшенням і навіть зникненням електричного заряду частинок. При висолюванні ВМС заряди витісняються з подвійного електричного поля. При цьому менш розчинна речовина (ВМС) випадає й осад. Зменшення і зникнення розчинності речовини, що висолюється, пов'язане з «відняттям» молекулами або іонами електроліту розчинника, оскільки вони володіють більшою здібністю до сольватації.
Ф. Гофмейстер (1886) встановив ліотропні ряди. Так, у катіонів осаджуюча здатність ВМС зменшується в наступній послідовності: Li+ > Na+ > К+ > Rb+ > Сs+. Аналогічний ряд встановлений і для аніонів: SO42- > Сl- > NO3- > Вг- > I- > CNS-.
Місце розміщення катіона або аніона в такому ряду визначається його здатністю зв'язувати розчинник. Чим більше іон здатний зв'язувати молекули розчинника, тим краще висолюється з розчину полімер. Висолювання часто застосовується в хімії. Його використовують для отримання фарбників з водних розчинів, виділення окремих фракцій білків з сироватки крові та інших біологічних рідин. Висолювання білків доцільно проводити при значеннях рН, близьких до ІЕТ, оскільки збільшення або зменшення сН приводить до підвищення заряду і гідратації білків, їх розчинності.
ВМС можуть осідати з розчинів рідинами, які добре змішуються з розчинниками, але самі не здатні розчиняти ВМС. Їх називають не розчинниками . Так, білок з водного розчину можна виділити у вигляді осаду, додаючи етанол, а каучук з розчину в бензолі, додаючи ацетон. При додаванні не розчинника зростає взаємне тяжіння молекул ВМС, що приводить до витіснення молекул і іонів розчинника з сольватованих частинок і формуванні крупних агрегатів ВМС. Висолювання – оборотний процес, оскільки після видалення з осаду електроліту промиванням або діалізом ВМС знову розчиняється.
При дії електролітів на розчини ВМС типового виділення пластівців і утворення осаду у ряді випадків не відбувається. Формуються рідкі краплі різних розмірів, які злипаються, утворюючи суцільний шар. Виникають дві рідини, що не змішуються, – концентрована (нижній шар, що складається майже з однієї дисперсної фази) і розбавлена (верхній шар). Таке розшарування розчину ВМС називається коацервацією, а нижній шар – коацерватом. Останній одержують, додаючи до розчину альбуміну концентрований розчин Na2SO4. А. І. Опарін вважав, що коацервати виконували велику роль в процесах походження життя на Землі.
Білкові речовини можуть денатурувати. Денатурація (від лат. dе – при-ставка, що позначає видалення, і natura – природа) – необоротні зміни физико-хімічних властивостей білків під впливом тих або інших дій. Денатурація відбувається при нагріванні, дії іонів важких металів, органічних розчинників, кислот, лугів, алкалоїдних реактивів, ультразвука, іонізуючого опромінювання і ін. Вона пов'язана із структурною перебудовою білковоїі молекули. Відбувається різке зменшення гідрофільності білка. Послабляються внутрішньомолекулярні зв'язки молекули, що формують його вторинну, третинну і четвертинну структуру. Відбувається розрив і переміщення водневих зв'язків, розкручуються поліпептидні ланцюги, глобулярна форма молекул переходить у фібрилярну, гідрофобну ділянки молекули, які раніше були в глибині, приходять в зіткнення з водою. При цьому втрачається здібність до набухання, зникають каталітичні (для ферментів) і інші властивості білків, посилюються кольорові реакції на білки. На біофабриках, де виготовляються вакцини, сироватки, антигени і інші біопрепарати, для запобігання денатурації імунних білків їх виділяють при низьких температурах у присутності нейтральних солей. (NH4)2S04, насичених розчинів глюкози, сахарози або гліцерину. Для цих цілей застосовується і ліофільна сушка, тобто висушування заморожених препаратів в умовах глибокого вакууму.
В'язкість розчинів ВМС
В'язкість розчинів ВМС відрізняється від в'язкості золю і істинних розчинів. У низькомолекулярних розчинів і золю існує пропорційна залежність між концентрацією і в'язкістю. У розчинів ВМС із збільшенням концентрації в'язкість непропорційно зростає. Таке зростання відбувається унаслідок збільшення об'єму дисперсної фази розчину ВМС в результаті її гідратації і наявності в системі гнучких молекул. В'язкість розчинів визначається як опір рідини пересуванню одного її шару щодо іншого. Великі набряклі молекули ВМС збільшують силу тертя між шарами.
Розбавлені розчини (концентрація близько 1 %) мають в'язкість, що перевищує в 18-20 разів в'язкість чистого розчинника. В'язкість розчинів ВМС в середньому перевищує в'язкість розчинників на 13-15 порядків. Макромо-лекули в розчині згинаються, утворюють клубки і обертаються в потоці. Це збільшує тертя сегментів макромолекули з молекулою розчинника. Механізм перебігу концентрованих розчинів ВМС наближається до механізму перемі-щення самих полімерів.
Г. Штаудінгер (1881-1965) запропонував формулу визначення в'язкості розчину ВМС з урахуванням того, що в ньому молекули полімеру не взаємодіють між собою (для розбавлених розчинів):
![]() (4
(4
де
![]() – в'язкість розчину;
– в'язкість розчину;
![]() – в'язкість розчинника;
– в'язкість розчинника;![]() –
питома
в'язкість;
к –
константа для кожного полімергомологічного
ряду;
М –
молекулярна маса
полімеру; С – концентрація розчину,
виражена в «основних молях» на літр
(«основний моль» – число
грам
полімеру, чисельно рівне молекулярній
масі мономера).
–
питома
в'язкість;
к –
константа для кожного полімергомологічного
ряду;
М –
молекулярна маса
полімеру; С – концентрація розчину,
виражена в «основних молях» на літр
(«основний моль» – число
грам
полімеру, чисельно рівне молекулярній
масі мономера).
Рівняння (1) використовується і для визначення молекулярної маси полімеру.
В'язкість розчинів ВМС залежить від природи розчинника. У різних розчинниках вона відрізняється на 1000 і більше разів; у розчинниках, які мають хімічну спорідненість з полімером, вона більше, ніж у тих, де полімер погано розчинимо. Тут сольватація макромолекул незначна і вони згортаються в клубок .
Підвищення температури веде до зменшення в'язкості розчинів ВМС. Так, у біополімерів (наприклад білків) мінімальна в'язкість спостерігається при ІЕТ. Максимальна в'язкість виникає при найбільшій іонізації макромолекули. Додавання до розчину ВМС протилежно заряджених іонів підвищує його в'язкість. В'язкість розчинів ВМС зростає із збільшенням тиску, оскільки відбувається орієнтація частинок паралельно потоку і руйнуються глобулярні утворення макромолекул. Підвищення концентрації розчину вибуває утворення асоціатів з макромолекул, а це утрудняє перебіг розчину і підвищує в'язкість. Такі структури руйнуються при підвищенні температури, струшуванні п перемішуванні.
