
- •Министерство образования и науки российской федерации
- •Федеральное государственное бюджетное образовательное учреждение высшего образования
- •«Уфимский государственный университет экономики и сервиса»
- •(Угуэс)
- •Тема 1 Основные понятия и законы.
- •Тема 2 Основные классы неорганических веществ
- •Химические свойства соединений основных классов соединений
- •Тема 3 Строение атома. Химическая связь
- •Тема 4 Химическая связь
- •Тема 5 Основные понятия о химической кинетике.
- •Тема6 Растворы. Способы выражения концентрации растворов
- •Тема7 Растворы электролитов. Электролитическая диссоциация. Ионное произведение воды. Гидролиз
- •Тема 8 Ионное произведение воды и рн растворов кислот и оснований
- •Тема 9 Гидролиз солей
- •Тема10 Степень окисления. Окислительно-восстановительные реакции
- •Список литературы
- •Контрольная работа по дисциплине химия
Тема6 Растворы. Способы выражения концентрации растворов
Пример Найти массу AlCl3, необходимую для приготовления 2 л раствора этой соли с массовой долей 12%. Плотность раствора ρ=1090 кг/м3 (1090 г/л). Вычислите нормалльность (молярную концентрацию эквивалента), молярность (молярную концентрацию), моляльность и титр раствора.
Решение:
1. Масса раствора m(р-ра) = V ∙ρ, m(р-ра) = 2л∙1090 г/л = 2180 г
2. Массовая доля ω – число граммов растворенного вещества в 100 г раствора
![]()
Находим массу AlCl3 для приготовления 2 л раствора с массовой долей 12%.
![]()
3. По таблице Менделеева находим молярную массу AlCl3 (потребуется для расчета молярной концентрации) и вычисляем молярную массу эквивалента AlCl3 (потребуется для расчета нормальной концентрации).
М(AlCl3) = 27+3∙35,5=133,5 (г/моль) – молярная масса AlCl3,
МЭКВ(AlCl3) = 133,5/3 = 44,5 г/моль-экв – молярная масса эквивалента AlCl3.
Как найти эквивалет соли описано в главе 1.
Находим число молей AlCl3 (количество вещества) и число моль-эквивалентов
n(в-ва)=m(в-ва)/М(в-ва)=261,6 / 133,5 = 1,96 (моль)
nэкв(в-ва)=m(в-ва)/Мэкв(в-ва)= 261,6 / 44,5= 5,88 моль-экв
4. Находим молярную концентрацию СМ, т.е. число молей AlCl3 в 1 л раствора.
См = n / V = 1,96 /2 = 0,98 моль/л
5. Находим молярную концентрацию эквивалента (нормальность) СH, т.е. число эквивалентов вещества в 1 л раствора (моль-экв/л), т.е.
|
Сн = См для NaCl |
Сн = 3См для AlCl3 |
|
Сн = 2См для CaCl2, CuSO4 |
Сн = 6См для Al2(SO4)3 |
6. Находим моляльность раствора Сm, т.е. число молей растворенного вещества в 1 кг растворителя (моль/кг). Для этого найдем массу воды.
m(воды) = m(р-ра) – m(в-ва) = 2180,0 г – 261,6 г = 1918,4 г=1,92 кг
![]() =
=![]() =
1,02 моль/кг.
=
1,02 моль/кг.
7. Находим титр раствора, т.е. массу (г) растворенного вещества, содержащегося в 1 мл раствора.
![]()
![]()
![]() 0,1308
г/мл.
0,1308
г/мл.
Задание 6 контрольной работы
Найдите
массу соли, необходимую для приготовления
раствора объемом V
л с массовой долей ![]() .
Плотность раствора
.
Плотность раствора ![]() Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
моляльность и титр этого раствора.
Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
моляльность и титр этого раствора.
|
Вариант |
Соль |
V, л |
|
ρ, кг/м3 |
|
151 |
AlCl3 |
0,5 |
6 |
1052 |
|
152 |
AgNO3 |
1,5 |
8 |
1069 |
|
153 |
AgNO3 |
0,8 |
6 |
1050 |
|
154 |
Al2(SO4)3 |
0,8 |
6 |
1061 |
|
155 |
Al2(SO4)3 |
1,5 |
4 |
1040 |
|
156 |
BaCl2 |
3,0 |
4 |
1034 |
|
157 |
BaCl2 |
0,3 |
2 |
1015 |
|
158 |
CaCl2 |
0,5 |
12 |
1083 |
|
159 |
CaCl2 |
0,9 |
4 |
1031 |
|
160 |
CuSO4 |
2,5 |
8 |
1084 |
|
161 |
CuSO4 |
0,65 |
2 |
1019 |
|
162 |
FeCl3 |
0,9 |
12 |
1085 |
|
163 |
FeCl3 |
1,7 |
6 |
1049 |
|
164 |
FeSO4 |
1,5 |
4 |
1037 |
|
165 |
FeSO4 |
3,5 |
8 |
1078 |
|
166 |
K2CO3 |
2,0 |
12 |
1090 |
|
167 |
K2CO3 |
0,6 |
2 |
1016 |
|
168 |
K2Cr2O7 |
2,5 |
8 |
1055 |
|
169 |
K2Cr2O7 |
0,4 |
6 |
1040 |
|
170 |
K2SO4 |
3,0 |
6 |
1047 |
|
171 |
K2SO4 |
1,2 |
12 |
1081 |
|
172 |
MgSO4 |
4,0 |
4 |
1039 |
|
173 |
MgSO4 |
1,6 |
6 |
1060 |
|
174 |
Na2CO3 |
0,5 |
12 |
1102 |
|
175 |
Na2CO3 |
3,5 |
2 |
1019 |
|
176 |
Na2SO4 |
3,5 |
8 |
1072 |
|
177 |
Na2SO4 |
1,7 |
6 |
1053 |
|
178 |
Pb(NO3)2 |
1,5 |
6 |
1052 |
|
179 |
Pb(NO3)2 |
2,5 |
8 |
1072 |
|
180 |
Pb(NO3)2 |
0,5 |
12 |
1016 |
|
Таблица 5 Способы выражения содержания растворенного вещества в растворе | ||||
|
Название концентрации (синоним) |
Обозна-чение |
Способ выражения содержания растворенного вещества в растворе |
Формула |
Единица измерения |
|
Массовая доля (процентная концентрация) |
ω |
Отношение массы растворенного вещества к общей массе раствора |
где ρ – плотность раствора |
% |
|
Мольная доля |
Хi |
Отношение количества (числа молей) растворенного вещества к сумме количеств (числа молей) всех веществ, находящихся в растворе. |
где Σ ni – сумма количеств (молей) всех веществ в растворе |
– |
|
Молярная концентрация (молярность) |
См, или М |
Количество (число молей) растворённого вещества в единице объёма раствора (в 1 литре) |
где М – молярная масса вещества |
моль/л, |
|
Молярная концентрация эквивалента (нормальная концентрация, нормальность) |
Сн, или N |
Количество эквивалентов (число молей эквивалентов) растворённого вещества в единице объёма раствора (в 1 литре) |
Мэкв – молярная масса эквивалента, fэкв – фактор эквивалентности |
моль-экв/л |
|
Моляльная концентрация (моляльность) |
Сm |
Количество растворённого вещества (число молей) в 1000 г растворителя |
|
моль/кг |
|
Титр раствора |
Т |
Масса вещества, содержащегося в 1 мл раствора |
|
г/см3 кг/см3 |

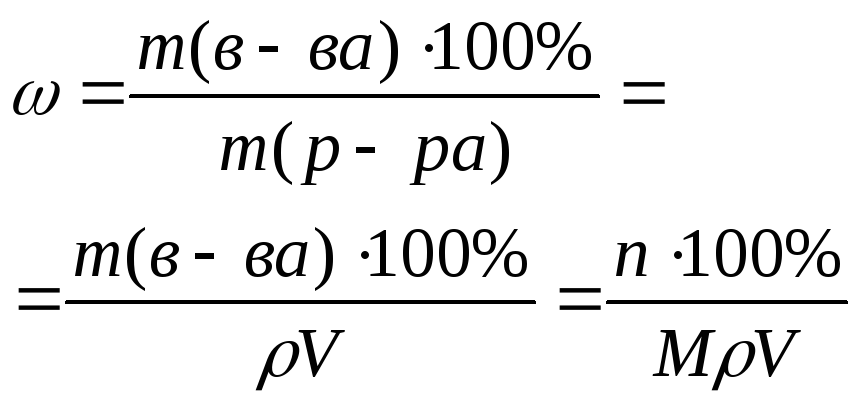 ,
,