
- •Министерство образования и науки российской федерации
- •Федеральное государственное бюджетное образовательное учреждение высшего образования
- •«Уфимский государственный университет экономики и сервиса»
- •(Угуэс)
- •Тема 1 Основные понятия и законы.
- •Тема 2 Основные классы неорганических веществ
- •Химические свойства соединений основных классов соединений
- •Тема 3 Строение атома. Химическая связь
- •Тема 4 Химическая связь
- •Тема 5 Основные понятия о химической кинетике.
- •Тема6 Растворы. Способы выражения концентрации растворов
- •Тема7 Растворы электролитов. Электролитическая диссоциация. Ионное произведение воды. Гидролиз
- •Тема 8 Ионное произведение воды и рн растворов кислот и оснований
- •Тема 9 Гидролиз солей
- •Тема10 Степень окисления. Окислительно-восстановительные реакции
- •Список литературы
- •Контрольная работа по дисциплине химия
Тема 4 Химическая связь
Химическая связь – это взаимное сцепление атомов в молекуле в результате перекрывания их электронных облаков. Образованию химической связи может предшествоватьгибридизация АО: преобразование различающиеся по форме и энергии АО разных подуровней в такое же количество гибридных молекулярных орбиталей. Гибридные орбитали имеют одинаковую энергию и форму, что обеспечивает равноценность образующихся связей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание с орбиталями присоединяющегося атома, чем негибридизованные. В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. Тип гибридизации АО центрального атома определяет геометрическую форму образующихся молекул или ионов.
Таблица 4
Форма молекул и тип гибридизации центрального атома
|
Гибридизация центрального атома |
Геометрическая форма молекулы или иона |
Угол между связями |
Пример молекулы или иона |
|
sp |
Линейная |
180° |
BeF2, CH≡CH, [Ag(NH3)2]+ |
|
p2 |
Угловая |
90° |
H2S, TeCl2 |
|
sp3 |
Угловая |
~109,5° |
H2O |
|
sp2 |
Плоский треугольник |
120° |
BF3, CO32– |
|
sp2 |
Плоский прямоугольник |
120° |
CH2=CH2 |
|
sp3 |
Тетраэдр |
109,5° |
CH4, NH4+ |
|
d 3s |
Тетраэдр |
109,5° |
TiCL4 |
|
sp3 |
Тригональная пирамида |
~109,5° |
NH3, Н3О+, SО32– |
|
sp3d |
Тригональная бипирамида |
90°, 120° |
PCl5, |
|
sp3d2 |
Октаэдр |
90° |
SF6, [АlF6]33– |
|
d2sp3 |
Октаэдр |
90° |
[Fе(СN)6]4– |
|
dsp2 |
Плоский квадрат |
90° |
[PdСl4]2– |
Рассмотрим образование молекул с разным типом гибридизации центрального атома.
При образовании молекулы ВеF2 атом бериллия переходит в возбужденное состояние и имеет два неспаренных электрона один на 2s- и один на 2р-орбитали. Гибридизация этих АО приводит к образованию двух sp-гибридных молекулярных орбиталей, расположеных в молекуле под углом 180°, поскольку в таком случае электроны на этих орбиталях испытывают наименьшее взаимное отталкивание. В результате молекула ВF2 имеет линейное строение. Молекула неполярна. В молекуле две равноценные σ-связи Be–F, π-связей нет. Связи полярны, электронная плотность смещена к более электроотрицательному атому F. На рисунке для атомов F показаны только 2р-электроны, образующие связи.
а)
б)
F
Be
F


Рисунок 2 Молекула BeF: а) sp-гибридизация АО бериллия и образование двух σ-связей; б) пространственное строение молекулы
При образовании молекулы ВF3 три неспаренных электрона атома бора в возбужденном состоянии расположены на АО 2s, 2рх, 2рz. В результате гибридизации образуются три гибридные sp2-орбитали. Для достижения минимального отталкивания гибридные орбитали направлены в углы правильного треугольника, углы между орбиталями равны 120°. В результате молекула ВF3 имеет форму плоского треугольника, ядро атома бора располагается в центре. Молекула ВF3 неполярна. В молекуле три σ-связи, все связи равноценны, π-связей нет. Связи полярны, электронная плотность смещена в строну атома F.
б)
в)
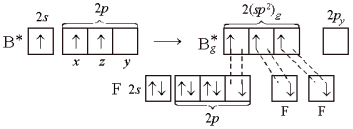
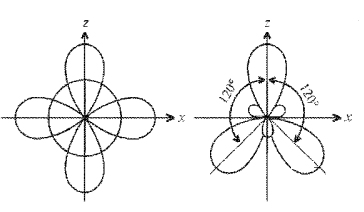
Рисунок 3 Молекула ВF3: а) гибридизация АО бора и образование трех σ-связей; б) ориентация в пространстве исходных атомных 2s-, 2рx- и 2рz-орбиталей; в) ориентация в пространстве гибридных sp2-орбиталей
При образовании связей атомами C, N, О и Cl в гибридизации участвуют одна s-орбиталь и три p-орбитали, во всех случаях образуются четыре sp3-гибридные орбитали, направленные в пространстве от ядра к углам тетраэдра. Углы между орбиталями во всех случаях близки к 109°, однако форма молекул, образуемых этими атомами различны.
В молекуле метана СН4 четыре σ-связи, π-связей нет, связи полярны, электронная плотность смещена к атому С. Форма молекулы тетраэдрическая, молекула неполярна, угол между орбиталями равен 109,46°.
а)
б)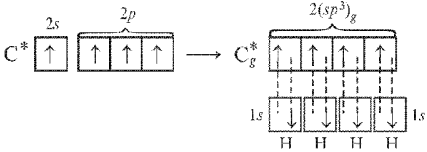
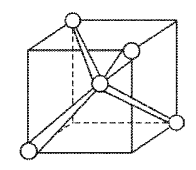
Рисунок 4 Молекула СН4: а) гибридизация АО углерода и образование четырех σ-связей; б) ориентация в пространстве гибридных sp3-орбиталей
В
+
NH3
NH4+
тригональная
пирамида тетраэдр
а)
б)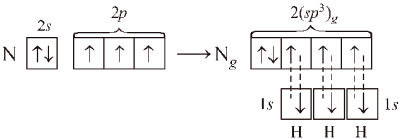

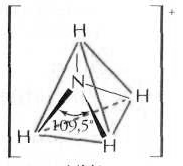
Рисунок 5 Молекула NH3: а) гибридизация АО азота, образование гибридных sp3-орбиталей и трех σ-связей; б) пространственное строение молекулы NH3 и иона NH4+
В молекуле воды Н2О на двух sp3-гибридных орбиталях кислорода располагается неподеленные пары электронов. В молекуле две σ-связи, π-связей нет. Вследствие отталкивания неподеленных электронных пар, угол между связями О–Н отклоняется от тетраэдрического и составляет 104,5°.
б)
а)
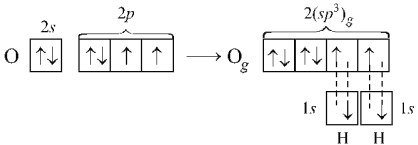
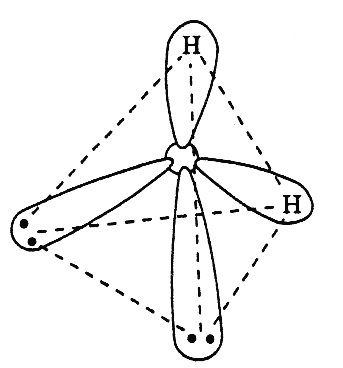
Рисунок 6 Молекула H2О: а) гибридизация АО кислорода, образование гибридных sp3-орбиталей и двух σ-связей; б) пространственное строение молекулы H2О.
При образовании комплексного иона [АlF6]33– в гибридизации участвуют вакантные 3d-орбитали алюминия и образуется шесть гибридных sp3d2-орбиталей, направленных к углам октаэдра. Форма иона октаэдрическая, число σ-связей шесть, угол между связями 90°, π-связей нет.
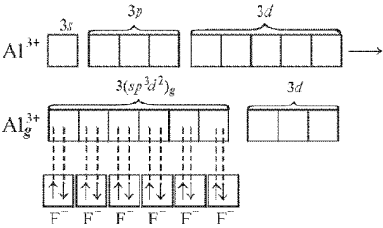
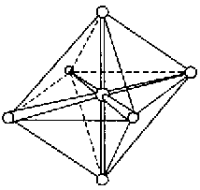
Рисунок 7 Образование иона [АlF6]33– и ориентация sp3d2-гибридных орбиталей
Комплекс [Fе(СN)6]4– тоже имеет октаэдрическую форму, хотя гибридизация d2sp3-типа. Гибридизация с участием d-орбиталей приводит также к квадратной и тетраэдрической формам молекул и ионов.
Задание 4 контрольной работы
Определить пространственную структуру молекулы, тип гибридизации центрального атома (если есть), число σ- и π-связей, полярность связей и полярность молекулы в целом.
|
Вариант |
Молекула |
Вариант |
Молекула |
Вариант |
Молекула |
|
91 |
H2O |
101 |
AsH3 |
111 |
CO2 |
|
92 |
PH3 |
102 |
[PtСl4]2– |
112 |
BeI2 |
|
93 |
Cl2 |
103 |
BeBr2 |
113 |
SO2 |
|
94 |
CO32– |
104 |
SCl6 |
114 |
H2Te |
|
95 |
NH3 |
105 |
N2 |
115 |
HI |
|
96 |
CF4 |
106 |
SiH4 |
116 |
I2 |
|
97 |
C2H2 |
107 |
BCl3 |
117 |
[АlF6]33– |
|
98 |
SiF4 |
108 |
H2Se |
118 |
CCl4 |
|
99 |
OF2 |
109 |
HBr |
119 |
AlCl3 |
|
100 |
TiCl4 |
110 |
C2H4 |
120 |
COCl2 |
