
химия
.pdf
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Общая и биоорганическая химия
Курс лекций для студентов лечебного, педиатрического,
московского и стоматологического факультетов
Тема 9
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Подготовлено в рамках реализации Программы развития РНИМУ
Кафедра общей и биоорганической химии
1

Окислительно-восстановительные процессы
●Окислительно-восстановительные реакции (ОВР)
●Электродные потенциалы
●Гальванические элементы
●Электродвижущая сила (ЭДС) гальванического элемента.
●Направление окислительно-восстановительного процесса
●Мембранный потенциал
2

Окислительно-восстановительные реакции (ОВР)
Окисление — процесс, в котором атомы, молекулы или ионы
отдают электроны.
Восстановление — процесс, в котором атомы, молекулы или
ионы приобретают электроны.
O Восстановители — атомы, ионы или молекулы, отдающие электроны
другим атомам в ходе окислительно-восстановительного процесса (Н2, металлы, HI).
— Отдавая электроны, восстановители окисляются.
OОкислители — атомы, ионы или молекулы, присоединяющие электроны (O2, галогены, HNO3, KMnO4).
—Принимая электроны, окислители восстанавливаются.
2FeCl2 + Cl2 → 2FeCl3 |
(9.1) |
ОВР включают частичный или полный переход электронов от
одних атомов или ионов к другим с изменением степени окисления этих атомов.
—Степень окисления железа изменилась с +2 до +3, а молекулярного хлора — с 0 до –1.
3
Степень окисления — заряд, которым обладал бы атом в
химическом соединении, если бы электроны каждой образованной им химической связи были бы полностью смещены к более электроотрицательному атому.
(FeCl2: Fe+2, 2Cl–1; NaH: Na+1, H–1; CCl4: C+4, 4Cl–1; CH4: C–4, 4H+1)
—Степень окисления атома в простом веществе равна нулю (Cl2: 2Cl0);
—Сумма степеней окисления всех атомов, входящих в состав молекулы, равна нулю;
—Сумма степеней окисления всех атомов, входящих в состав сложного иона, равна заряду иона.
Окислительно-восстановительные реакции можно условно разделить на две полуреакции
Пример. Для реакции (9.1). |
|
|
|||
FeCl2 |
– |
ē |
→ FeCl3 |
|
полуреакция окисления |
2 |
|||||
2Cl0 |
+ |
2ē |
→ 2Cl– |
1 |
полуреакция восстановления |
4

Электродные потенциалы *
Возникновение двойного электрического слоя (ДЭС) на границе металл—раствор
Пластинка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Электрод |
Пластинка |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
металла в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
приобретает |
водном растворе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
заряд |
В растворе |
Раствор |
|
|
|
|
|
|
|
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
положительно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Скачок потенциала |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
заряженные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– – – – |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ДЭС |
на границе |
|||||
гидратированные |
|
|
+ + + + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
металл–раствор |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
Z+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
ионы металла |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1. Полуэлемент
ДЭС – упорядоченное распределение противоположно
заряженных частиц на межфазной границе.
Электродный потенциал — разность электрических
потенциалов (скачок потенциала) на границе металл– раствор электролита.
* Обозначается Е или φ |
5 |
|

Зависимость электродных потенциалов (E) от различных факторов
—природа металла, концентрация (активность) ионов металла
врастворе, температура.
Уравнение Нернста
— математическое выражение зависимости E от ряда факторов.
E |
Me |
Z + |
/Me |
= E0 |
Z |
+ |
+ RT ln[MeZ+ ] |
(9.2)* |
|
|
Me |
|
/Me ZF |
|
|||
|
|
|
|
|
|
|
E(Mez+/Me) — электродный потенциал; R — универсальная газовая постоянная;
T — абсолютная температура; F — постоянная Фарадея ; z — заряд иона металла; [Mez+] — концентрация иона металла (моль/л); E0(Mez+/Me) — стандартный электродный потенциал
рациональная форма записи уравнения Нернста (при 25 °C )
E |
|
|
= E0 |
|
|
+ |
0,06 |
lg[MeZ+ ] (9.3)* |
Z+ |
/Me |
Z+ |
/Me |
|
||||
Me |
|
Me |
|
|
Z |
|||
|
|
|
|
|
|
|
||
* Для разбавленных растворов
6

Стандартный электродный потенциал E0298 (Mez+/Me)
— потенциал, возникающий на границе металл–раствор при
концентрации (активности) потенциалопределяющих ионов 1 моль/л и температуре 298 K.
Стандартный водородный электрод * (электрод сравнения)
—соответствует концентрации (активности) [Н+] 1 моль/л, давлению p(H2) 101.3 кПа (1 атм) и температуре 298 K.
Электродная
реакция
2H+ + 2ē |
|
H |
|
||
|
||
|
2 |
|
Уравнение Нернста для водородного электрода
E + = |
0,06 |
lg[H |
+ |
] |
2 |
= −0.06pH |
(9.4) |
|
|||||||
|
|
|
|
|
|
|
2H /H2 |
2 |
|
Стандартный электродный потенциал водородного электрода E0298
(2Н+/Н2) принят равным нулю. По отношению к нему определяют остальные потенциалы.
* Устройство водородного электрода см. ББХ, стр. 365.
7
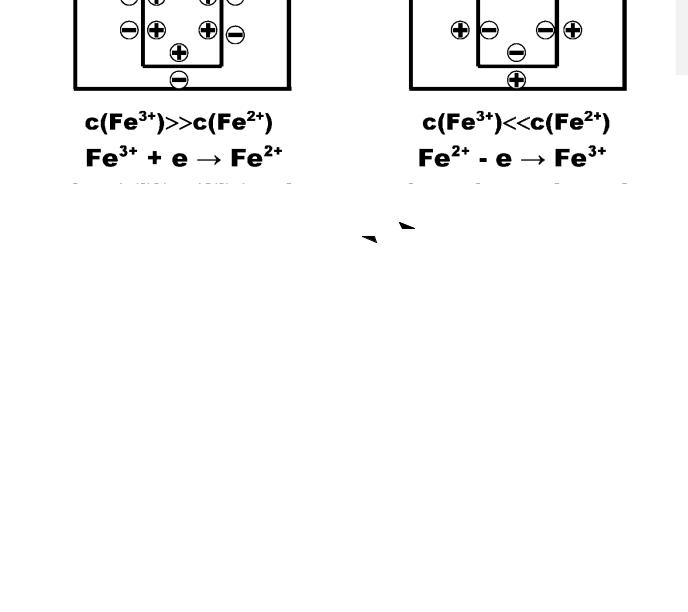
Окислительно-восстановительный электрод (редокс-электрод)
— электрод из инертного металла (платина или графит), погруженный в раствор, содержащий окисленную и восстановленную формы участников одной полуреакции, например Fe3+/Fe2+.
Равновесие между окисленной и восстановленной формами
Fe3+ + ē |
|
Fe2+ |
|
||
|
||
|
|
|
Рис. 2. Схема возникновения редокс–потенциала
8

Восстановительный потенциал (редокс-потенциал) —
потенциал, возникающий в системе, состоящей из инертного металла и раствора, содержащего окислительно-восстанови- тельную пару.
Уравнение Нернста–Петерса
|
0 |
|
RT |
[Ox] |
||
E = E |
|
+ |
|
ln |
|
(9.5)* |
|
|
|
||||
|
|
|
ZF |
[Red] |
||
E0 — стандартный редокс-потенциал при концентрациях (активностях) участников полуреакции 1 моль/л и температуре 298 K
рациональная форма записи уравнения Нернста-Петерса (при 25 °C )
E = E0 + |
0,06 |
lg |
[Ox] |
|
(9.6)* |
|
|
||||
|
Z |
[Red] |
|
||
Стандартный биологический восстановительный потенциал
(E0') — характеризует биохимические окислительно-восстанови- тельные процессы, протекающие при температуре 37 °C (310 К) и pH = 7.
* Для разбавленных растворов |
9 |

Примеры. Записать уравнение Нернста или Нернста–Петерса для следующих систем
а) Cu2+ + 2ē → Cu; б) Fe3+ + ē → Fe2+ и в) ClO3 + 6H+ 6ē → Cl- + 3Н2О
a. |
E |
|
2+ |
|
|
|
|
RT |
2+ |
|
или |
|||
(Cu |
/Cu) = +0.337 |
+ |
|
|
2F |
|
ln[Cu ] |
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
2+ |
|
|
|
0.06 |
|
lg[Cu2+] |
|
|
|||
|
E |
(Cu |
|
+ |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||||||
|
|
/Cu) = +0.337 |
|
2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
[Fe3+] |
||||
б. |
|
3+ |
2+ |
|
|
|
RT |
|
|
|||||
E |
|
|
|
|
|
|
ln |
|
|
или |
||||
|
/Fe |
) = +0.771 |
+ |
|
|
|
|
|
|
|
||||
|
(Fe |
|
|
1F |
2+ |
|
|
|||||||
|
|
|
|
|
|
|
|
] |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
[Fe |
|
|
E |
3+ |
|
2+ |
|
|
0.06 |
|
lg |
|
|
[Fe3+] |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
(Fe |
/Fe |
) = +0.771 |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
1 |
|
|
|
|
2+ |
] |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
[Fe |
|
|
|||
в. E |
- |
|
+ |
|
- |
|
|
|
|
RT |
|
ln |
[ClO3-] [H+]6 |
или |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
(ClO3 |
, 6H /Cl ,3H2O) = +1.45 + |
6F |
|
|
|
|
[Cl-] |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
E |
|
- |
|
+ |
- |
|
|
|
|
0.06 |
|
lg |
[ClO3-] [H+]6 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
(ClO3 , 6H /Cl ,3H2O) = +1.45 + |
6 |
|
|
|
|
|
[Cl-] |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|||
