
- •Моногалогенопроизводные
- •I. Моногалогенопроизводные, галоидные алкилы.
- •Методы получения
- •1. Реакции нуклеофильного замещения атома галогена (Hal)
- •Характеристика связей углерод-галоген
- •II. Реакции элиминировании (е) (отщепления) в ряду моногалогенозамещенных.
- •III. Реакции моногалогенопроизводных с металлами
- •3. Получение литийорганических соединений.
- •Алкенилгалогениды
- •Одноатомные спирты (алканолы)
- •II. Спирты – основания и нуклеофилы
- •1. Проявление оснόвных свойств
- •2. Проявление нуклеофильных свойств
- •III. Реакции замещения он-группы
- •2. Реакции замещения он группы на галоген.
- •IV. Внутримолекулярная дегидратация
- •V. Окисление и дегидрирование спиртов
- •Многоатомные спирты
- •Методы получения
- •2.Образование сложных эфиров
- •3. Реакция замещения он-группы на галоген
- •5. Периодатное окисление
- •Простые эфиры
- •II. Нуклеофильные свойства
Многоатомные спирты
Диолы (гликоли) содержат две гидроксильных группы. При вицинальном расположении гидроксильные группы находятся у соседних атомов углерода, как в этиленгликоле. Если гидроксильные группы находятся при одном атоме углерода, диол называют геминальным, он нестабилен, легко дегидратируется с образованием карбонильных соединений.

Триолы (глицериновые)

Методы получения
Для диолов
1. Гидроксилирование алкенов (см. тему “Алкены”).
2. Гидролитическое расщепление оксидов алкенов или оксиранов (трехчленный цикл, содержащий атом кислорода).

Получение глицерина

Реакционная способность
1. Слабые ОН-кислоты, но более сильные, чем одноатомные спирты (сказывается бόльшее количество гидроксильных групп и их взаимное влияние друг на друга).
рКа этиленгликоля 14,18
рКа глицерина 13,99
рКа метанола 16,0
Гликоли и глицерины образуют алкоголяты, аналогично одноатомным спиртам. Отличительным свойством многоатόмных спиртов является образование соединений типа хелатов (от греч. сhélé - клешня) с ионами тяжелых металлов. С гидроксидом меди образуется раствор синего цвета (качественная реакция).

2.Образование сложных эфиров
Реакции проводят с избытком реагентов. В качестве реагентов используют азотную кислоту и карбоновые кислоты.

Образование сложных эфиров из глицерина и высших карбоновых кислот будет описано в теме “Жиры и масла”.
3. Реакция замещения он-группы на галоген


Окилительная дегидратация


5. Периодатное окисление
Метод применяется для установления строения полиолов с вицинальным расположением гидроксильных групп.

Примеры реакций:




Контрольные вопросы к главе МНОГОАТОМНЫЕ СПИРТЫ»
1. Напишите реакции этиленгликоля (этандиола-1,2) со следующими реагентами: а)Na; б) HBr; в) СН3СООН, H+; г) НNO3, Н2SO4; д) НIO4.
2. Напишите реакции глицерина (пропантриола-1,2,3) со следующими реагентами: а)Na; б) Cu(OН)2; в) HBr; г) СН3СООН, H+; д) С17Н33СООН (H+ , 200C); е) 3НNO3, Н2SO4; ж) НIO4.
Простые эфиры
Соединения, в которых алкильные группы связаны через атом кислорода называются простыми эфирами.
Примеры соединений


Краун-эфиры (от англ. crown - корона) образуют комплексы с солями щелочных металлов за счёт неподелённых пар электронов кислорода. Применяются в качестве катализаторов в ряде органических реакций.
Методы получения эфиров
1. Из первичных спиртов – под действием к.H2SO4/ 140; Al2O3/300С(см. тему “Спирты”).
2. Алкоголиз третичных спиртов (см. тему “Спирты”).
3. Реакция Вильямсона:


Реакционная способность
Простые эфиры являются нуклеофилами и основаниями за счет НПЭ атома кислорода. Атомы водорода в -положении простых эфиров являются подвижными за счёт смещения электронной плотности к атому кислорода.

1. Оснόвные свойства

Аналогично идут реакции с другими минеральными кислотами и кислотами Льюиса.
2. Реакции простых эфиров по связи -С-Н
б) Хлорирование
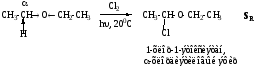
α-Галогенэфиры легко вступают в реакции замещения галогена и дегидрогалогенирования, их реакционная способность выше, чем у хлористого трет-бутила. Ниже приведены примеры реакций нуклеофильного замещения и элиминирования для 1-хлор-1-этоксиэтана.

ТИОЛЫ
(тиоспирты, меркаптаны)
Номенклатура

SH-сульфгидрильная группа
Методы получения

Реакционная способность

1. Тиолы - слабые SH-кислоты, но более сильные кислоты, чем спирты

2. Тиолы – нуклеофилы средней силы, тиолат-анион – сильный нуклеофил. Нуклеофильность тиолов и тиолат-анионов – более сильная, чем у спиртов и алкокси-анионов, что связано с меньшей электроотрицательностью атома серы и его более эффективной поляризуемостью.

Некоторые свойства тиоспиртов
1. Тиолы как кислоты и нуклеофилы.

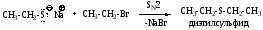

2. Другие свойства тиолов.

ТИОЭФИРЫ
(органические сульфиды)
Номенклатура

Методы получения

Реакционная способность
Тиоэфиры - более слабые основания, чем простые эфиры, но обладают большей нуклеофильностью.
Некоторые свойства тиоэфиров

Аналогично идет алкилирование спиртами в присутствии минеральных кислот и диалкилсульфатами. Тиоэфиры легко окисляются с образованием сульфонов и сульфоксидов.
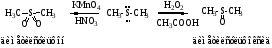
Группы SH и SCH3 являются структурными компонентами незаменимых аминокислот – цистеина и метионина соответственно.
АМИНЫ
Классификация – по числу алкильных групп при атоме азота.



Методы получения
1. Аммонолиз спиртов

2. Восстановительное аминирование альдегидов

3. Каталитическое гидрирование амидов и нитрилов
4. Каталитическое гидрирование нитроалканов
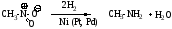
Строение и изомерия аминов
Амины и их четвертичные соли, как и аммиак имеют пирамидальное (тетраэдрическое) строение.
Модель молекулы метиламина

Реакционная способность аминов
Амины обладают основными и нуклеофильными свойствами, обусловленными наличием НПЭ у атома азота. Амины являются слабыми NH-кислотами.
I. Основные свойства аминов
Амины являются слабыми основаниями, гораздо слабее неорганических оснований. Амины реагируют с минеральными и органическими кислотами при 200С, при этом образуются соли. Вода, выступая в качестве ОН-кислоты, дает с аминами гидроксиды.

В солях и гидроксидах связь между алкил(диалкил или триалкиламмонийным) ионом и остатком кислоты ионная.
Основность аминов зависит от электронного эффекта заместителя (донор, акцептор). Доноры увеличивают электронную плотность на атоме азота, следовательно увеличивают основные свойства амина. Соответственно акцепторные группы снижают его основность, примеры приведены ниже.

pKb 9,8 10,7 10,6

Для того, чтобы выделить амин из его соли необходимо подействовать более сильным неорганичсеским основанием, например:

