
Врожд пороки
.pdfГОУ ВПО «Казанский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Кафедра хирургических болезней №2 Кафедра детской хирургии
ОСНОВЫ ДИАГНОСТИКИ И ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ВРОЖДЁННЫХ ПОРОКОВ СЕРДЦА
Методическое пособие для студентов старших курсов
Казань, 2009
ББК 54.5 УДК 616.1-089(035)
Печатается по решению Центрального координационно-методического совета Казанского государственного медицинского университета
Составители:
зав. кафедрой хирургических болезней №2, проф. Джорджикия Р.К., зав. кафедрой детской хирургии, проф. Миролюбов Л.М.,
доцент кафедры хирургических болезней №2, Харитонов Г.И., доцент кафедры хирургических болезней №2, Курмаев Ш.М., ассистент кафедры хирургических болезней №2, Билалов И.В.
Рецензенты:
зав. курсом сердечно-сосудистой хирургии, проф. Игнатьев И.М., зав. кафедрой кардиологии и ангиологии КГМА, профессор Маянская С.Д.
Основы диагностики и хирургического лечения врождѐнных пороков
сердца: Методическое |
пособие |
для |
студентов |
старших |
курсов |
/Р.К. Джорджикия, Л.М. |
Миролюбов, Г.И. |
Харитонов, |
Ш.М. |
Курмаев, |
|
И.В. Билалов. – Казань: КГМУ, 2009. |
– 67 с. |
|
|
|
|
Пособие посвящено клинике, диагностике и хирургическому лечению наиболее распространенных врождѐнных пороков сердца. Оно направлено на выработку у студентов старших курсов навыков: постановки предварительного диагноза больным с врождѐнными пороками сердца, создания оптимального алгоритма обследования таких пациентов и определения прогноза, в т.ч. необходимости хирургического лечения, а также возможных вариантов операции. Пособие может быть использовано интернами, ординаторами и слушателями системы последипломного образования.
© Казанский государственный медицинский университет, 2009
ОГЛАВЛЕНИЕ |
|
Методы диагностики пороков сердца……………………………………………….4 |
|
Лѐгочная артериальная гипертензия...…………………..………………….……...10 |
|
Открытый артериальный проток…………………………………..…….…………13 |
|
Дефект межпредсердной перегородки……………………………………..………18 |
|
Дефект межжелудочковой перегородки…………………………………………...24 |
|
Коарктация аорты…………………………………………………… |
........................31 |
Врождѐнный стеноз аорты………………………………………….........................36 |
|
Стеноз лѐгочной артерии……………………………………………........................ |
41 |
Тетрада Фалло……………………………………………………….........................46 |
|
Транспозиция магистральных сосудов…………………………….........................51 |
|
Открытый атриовентрикулярный канал (ОАВК)………………………….............54 |
|
Классификация критических состояний при врождѐнных пороках сердца у |
|
новорождѐнных……………………………………………………………………...59 |
|
Обеспечение операций на открытом сердце……………………………………….63 |
|
Список использованной литературы……………………………………….............67 |
|

4
МЕТОДЫ ДИАГНОСТИКИ ПОРОКОВ СЕРДЦА
1. Внешний осмотр Пороки сердца подразделяют соответственно изменениям окраски кожи и
слизистых оболочек на пороки бледного (без цианоза) и синего типа (с цианозом). При пороках бледного типа патологического сброса между артериальной и венозной системами нет (например при митральном стенозе), либо сброс происходит из левых камер сердца в правые (например при дефектах межпредсердной или межжелудочковой перегородок). При пороках синего типа сброс крови направлен справа налево. В эту группу входят сложные комбинированные пороки: тетрада Фалло, транспозиция магистральных сосудов, общий артериальный ствол и т.п. Как правило, состояние больных пороками синего типа критическое с рождения: без операции большинство из них погибают в младенчестве.
2. Аускультация сердца (рис. 1)
Чтобы выслушивать звуки, возникающие при работе клапанов сердца, стетоскоп следует располагать вдоль потока крови, проходящего через клапан.
Трикуспидальный клапан слышен слева от нижней части грудины вблизи пятого межреберья.
Митральный клапан слышен над верхушкой сердца – слева, в пятом межреберье по среднеключичной линии.
Клапан лѐгочной артерии слышен во втором межреберье слева от края грудины.
Клапан аорты слышен во втором межреберье справа от края грудины. Следует иметь в виду, что интенсивность патологических шумов сердца
зависит от размера отверстия, через которое протекает кровь, и от градиента давления между камерами сердца, соединяющимися этим отверстием. Например, систолический шум дефекта межпредсердной перегородки может быть очень слабым, так как градиент давления между предсердиями составляет 3-4 мм рт. ст, а размер дефекта достигает 1-1,5 см. Более того, шум этот возникает не в области дефекта перегородки, а в области устья лѐгочной артерии, через которую протекает избыточный объѐм крови. В то же время, дефект межжелудочковой перегородки дает очень сильный систолическимй шум, так как градиент давления между желудочками равен 80-90 мм рт. ст., а размер дефекта в среднем равен 0,5-0,7 см. Поэтому по интенсивности шума
никогда нельзя судить о тяжести порока сердца.
Кроме того, следует дифференцировать т.н. «сердечные» и «сосудистые» шумы». К последним можно отнести шумы при пороке аортального клапана и коарктации аорты. Эти шумы, хотя и слышны в проекции сердца, но всегда распространяются на большое расстояние от него по ходу крупных сосудов (на шею, в межлопаточное пространство).
Особенно тщательно следует выслушивать сердце у больных с
5
подозрением на митральный стеноз, имеющих фибрилляцию предсердий.
Нарушение ритма сердца приводит к ослаблению диастолического шума изгнания крови из предсердий. Таких больных рекомендуется выслушивать, когда они лежат в постели с небольшим поворотом на левый бок.
Рис. 1. Проекции клапанов сердца на грудную стенку и места их аускультации.
3. Электрокардиография позволяет выявить перегрузку отделов сердца, ишемию миокарда, нарушения ритма и проводимости. При гипертрофии правого желудочка в первом стандартном отведении зубец S глубокий, значительно превышает величину зубца R. Зубец Т положительный. Зубец R низкий, уширен, расщеплѐн. В третьем стандартном отведении зубец R высокий, сегмент S-T смещѐн вниз. Зубец Т низкий, двухфазный, иногда с преобладающей отрицательной фазой. При гипертрофии левого желудочка в первом стандартном отведении зубец R высокий, сегмент S-T смещѐн вниз. Зубец Т низкий, двухфазный, обычно с первой отрицательной фазой. В третьем стандартном отведении глубокий зубец S. При перегрузке обоих желудочков могут быть отклонение электрической оси сердца вправо, смещение сегмента S- T вниз во всех отведениях, низкий двухфазный зубец Т в стандартных отведениях и отрицательный в грудных отведениях. О перегрузке с перерастяжением левого предсердия может свидетельствовать фибрилляция предсердий (замещение зубцов Р волнами F). Перегрузка желудочков может приводить к возникновению желудочковых экстрасистол. Перегрузка одного желудочка может проявляться признаками неполной блокады пучка Гиса (расщеплением желудочкового комплекса), реально не существующей.

6
Иллюзию такой блокады создает запаздывание сокращения более нагруженного желудочка.
4. Обзорная рентгенография сердца в трѐх проекциях (рис. 2) позволяет получить данные о размерах камер сердца, перегрузке малого и большого кругов кровообращения. Это исследование особенно ценно при недоступности эхокардиографии.
Рис. 2. Обзорная рентгенография сердца: А - вторая косая проекция; Б - контуры сердца в прямой проекции; В - первая косая проекция. Обозначения: Ао – аорта, Ла – лѐгочная артерия, Пп – правое предсердие, Лп – левое предсердие, Лж – левый желудочек, Пж – правый желудочек.
Прямая проекция позволяет выявить а) переполнение сосудов малого круга кровообращения: расширение корней лѐгких, усиление лѐгочного рисунка и увеличение контура лѐгочной артерии (2 дуга); б) расширение контура восходящей аорты (1 дуга), возникающее при гипертонической болезни, аортальном пороке, аневризме восходящей аорты.
Вторая косая проекция позволяет дифференцировать увеличение желудочков. При расширении правого желудочка уменьшается пространство между тенью грудины и передней границей тени сердца. При расширении левого желудочка задний контур сердца приближается к позвоночнику.
Первая косая проекция позволяет дифференцировать увеличение предсердий. Исследование проводят одновременно с контрастированием пищевода сульфатом бария. Увеличенное левое предсердие, соприкасающееся с пищеводом, смещает его назад. При расширении правого предсердия тень сердца также смещается кзади, но положение пищевода не изменяется.
Рентгенография сердца иногда позволяет установить точный диагноз. Примеры: 1. Признаки лѐгочной гипертензии в сочетании с дилатацией левого предсердия и увеличением правого желудочка характерны для митрального стеноза; 2. Увеличение «2-й дуги» в сочетании с расширением правого предсердия и правого желудочка наблюдаются при дефекте межпредсердной перегородки; 3 Признаки лѐгочной гипертензии и увеличение левых камер сердца характерны для открытого артериального протока.
7
5. Эхокардиография Ниже приводятся нормальные показатели эхокардиограммы взрослого
человека.
Аорта – ширина до 3,7 см. Аортальный клапан – трѐхстворчатый, амплитуда раскрытия створок 1,5 – 2,6 см, фиброзное кольцо 2,5 см. Левое предсердие – 2,3-3,7 см, объѐм 41-58 мл. Левый желудочек: конечный диастолический размер (КДР) = 3,7-5,6 см, конечный диастолический объѐм (КДО) = 60-120 мл, конечный систолический размер (КСР) = 2,3-3,6 см, конечный систолический объѐм (КСО) = 40-60 мл. Фракция выброса левого желудочка по Тейхольцу = 54%. Межжелудочковая перегородка 0,6-1,1 см. Толщина задней стенки левого желудочка = 0,6-1,1 см. Площадь митрального отверстия = 4,0 см2. Движения створок митрального клапана – разнонаправленные. Правый желудочек (передне-задний размер) 2,5-3,0 см. Правое предсердие (объѐм) 41-50 мл. Систолическое давление в лѐгочной артерии (по трѐхстворчатой регургитации) 25-30 мм рт. ст.
Показатели ЭХО-КГ у детей меняются в зависимости от площади поверхности тела ребѐнка (см. ниже).
Нормальные значения у детей (М-режим ЭХО-КГ) в зависимости
от площади поверхности тела, мм
Площадь поверхности тела 0,7 м2
ПЖ |
10,8 |
5,1-16,4 |
ЛЖ (КДР) |
34,8 |
25,2-41,8 |
ЛП |
21,6 |
15,2-27,8 |
АО |
19,3 |
15,3-23,3 |
МЖП |
6,6 |
4,3-8,8 |
ЗСЛЖ |
5,7 |
3,5-7,8 |
Площадь поверхности тела 0,8 м2 |
|
|
|
|
|
ПЖ |
11,6 |
5,9-17,1 |
ЛЖ (КДР) |
36,1 |
26,8-42,5 |
ЛП |
22,3 |
16-28,5 |
АО |
20,0 |
16,1-24 |
МЖП |
6,9 |
4,6-9,1 |
ЗСЛЖ |
6,0 |
3,8-8,2 |
Площадь поверхности тела 0,9 м2 |
|
|
|
|
|
ПЖ |
12,3 |
6,7-17,9 |
ЛЖ (КДР) |
37,8 |
28,5-45 |
ЛП |
23,1 |
16,9-29,3 |
АО |
20,9 |
17-24,9 |
МЖП |
7,2 |
5-9,4 |
ЗСЛЖ |
6,3 |
4,2-8,5 |
|
|
|
8 |
|
|
|
|
|
|
Площадь поверхности тела 1,0 м2 |
|
|
||
|
|
|
|
|
ПЖ |
|
13,0 |
|
7,4-18,9 |
ЛЖ (КДР) |
|
39,5 |
|
30-46,5 |
ЛП |
|
24,0 |
|
17,8-30,1 |
АО |
|
21,8 |
|
17,9-25,8 |
МЖП |
|
7,5 |
|
5,3-9,7 |
ЗСЛЖ |
|
6,6 |
|
4,5-8,8 |
Площадь поверхности тела 1,1м2 |
|
|
|
|
|
|
|
|
|
ПЖ |
|
13,7 |
|
8,1-19,3 |
ЛЖ (КДР) |
|
41,0 |
|
31,6-48,4 |
ЛП |
|
24,8 |
|
18,5-30,9 |
АО |
|
22,7 |
|
18,8-26,7 |
МЖП |
|
7,8 |
|
5,6-10 |
ЗСЛЖ |
|
7,0 |
|
4,8-9,2 |
Площадь поверхности тела 1,2 м2 |
|
|
||
|
|
|
||
ПЖ |
|
14,3 |
|
8,8-20 |
ЛЖ (КДР) |
|
42,8 |
|
33,2-50 |
ЛП |
|
25,6 |
|
19,3-31,8 |
АО |
|
23,6 |
|
19,6-27,6 |
МЖП |
|
8,1 |
|
5,8-10,2 |
ЗСЛЖ |
|
7,3 |
|
5,2-9,5 |
Сокращения: ПЖ - правый желудочек; ЛЖ (КДР) – левый желудочек, конечный диастолический размер; ЛП – левое предсердие; АО – аорта; МЖП – толщина межжелудочковой перегородки; ЗСЛЖ – толщина задней стенки левого желудочка. Площадь поверхности тела можно рассчитать по формуле Костефф:
где S - поверхность тела человека, м2; P - масса тела, кг.
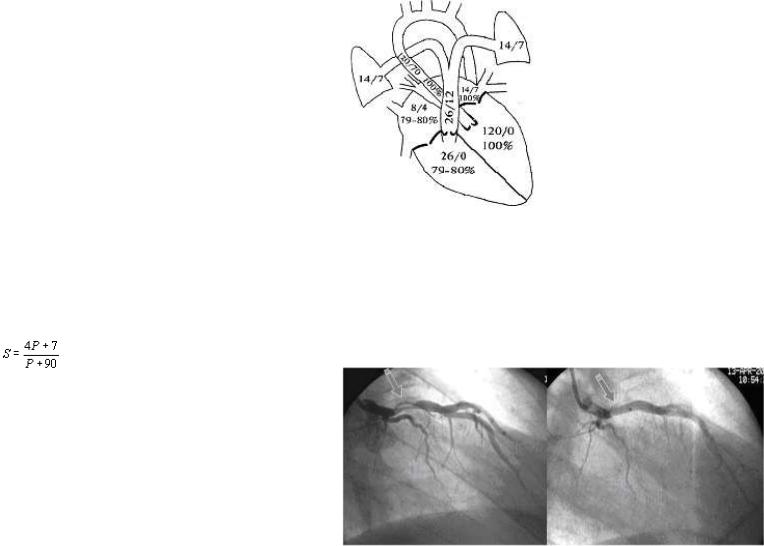
6. Зондирование полостей сердца и ангиокардиография (рис. 3).
Ранее этот метод исследования был основным в диагностике врождѐнных пороков сердца. В наше время равноценную информацию получают при эхокардиографии. Поэтому зондирование сердца и ангиокардиография производятся лишь в сложных диагностических случаях, например при врождѐнных пороках сердца «синего» типа. В частности, без ангиопульмонографии невозможно оценить развитость ветвей лѐгочной артерии у больных тетрадой Фалло, а именно от этого параметра зависит возможность одномоментной радикальной коррекции порока.
При зондировании полостей сердца перед рентгенохирургами ставятся следующие задачи: 1) «ощупывание» перегородок сердца с целью поиска дефектов в них (однако таким способом, как правило, удаѐтся найти лишь дефекты межпредсердной перегородки, поскольку межжелудочковые дефекты
9
обычно скрываются под створкой трикуспидального клапана или между мышечными трабекулами); 2) определение оксигенации (насыщения крови кислородом). Резкое повышение оксигенации крови внутри правых камер сердца свидетельствует о сбросе крови слева-направо при септальных дефектах. Аналогично, подъѐм оксигенации крови в лѐгочной артерии характерен для
ОАП; 3) измерение давления в полостях сердца; повышение давления в правых камерах сердца также может быть признаком септального дефекта либо стеноза клапана лѐгочной артерии.
За последнее десятилетие зондирование полостей сердца превратилось из диагностического мероприятия в лечебное. В частности, при зондировании устанавливаются окклюдеры в дефекты межпредсердной и межжелудочковой перегородок, стенты-эндопротезы при расслаивающих аневризмах брюшной аорты.
Рис. 3. Нормальные показатели давления и оксигенации крови в полостях сердца.
Отдельный вид ангиокардиографии – коронарография применяется для оценки анатомии коронарных сосудов сердца и локализации атеросклеротических бляшек, вызывающих ишемическую болезнь сердца. В некоторых случаях при ангиокардиографии может быть выполнена баллонная ангиопластика венечных сосудов (расширение стенозированных участков артерии специальным баллонным катетером) и установка в расширенные таким способом артерии стентов - каркасов, удерживающих сосуды в расширенном состоянии (рис. 4). В других случаях на основании коронарограмм могут быть разработаны операции маммароили аортокоронарного шунтирования.
Рис. 4. Стеноз ветви левой коронарной артерии до и после ангиопластики со стентированием.

10
7. Рентгеновская компьютерная томография (РКТ)
РКТ с ангиоконтрастированием широко применяется для диагностики тромбов лѐгочной артерии, расслаивающих аневризм аорты. Ниже представлен скан, на котором виден тромб в правой ветви лѐгочной артерии и отображены его размеры.
Особый вид КТ – мультиспиральная компьютерная томография (МСКТ) позволяет создавать трехмерные реконструкции сердца (рис.5).
Рис. 5. Компьютерные томограммы: слева – РКТ, справа – МСКТ.
На МСКТ стрелкой обозначен стеноз передней межжелудочковой ветви левой коронарной артерии
ЛЁГОЧНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Лѐгочная артериальная гипертензия (ЛАГ) определяется как группа заболеваний, характеризующихся прогрессивным повышением лѐгочного сосудистого сопротивления (ЛСС), что ведѐт к правожелудочковой недостаточности и преждевременной смерти. ЛАГ включает идеопатическую (или первичную) ЛАГ и лѐгочную гипертензию (ЛГ) при различных других состояниях, таких как заболевания соединительной ткани, врождѐнные шунты между системными и лѐгочными сосудами, тромбоэмболия лѐгочной артерии,
портальная гипертензия и ВИЧ-инфекция. При всех этих состояниях развиваются одинаковые обструктивные изменения в системе лѐгочной микроциркуляции. Как видим, кардиохирурги, оперирующие больных с врождѐнными пороками сердца «бледного типа», сталкиваются с одним из многих вариантов ЛАГ.
ЛГ определяется как среднее артериальное давление в лѐгочной артерии (ср. ДЛА) > 25 мм рт. ст. в покое или > 30 мм рт. ст. при физической нагрузке.
Повышение ЛСС связано с различными механизмами, в том числе с
11
вазоконстрикцией, обструктивным ремоделированием стенки лѐгочных сосудов, воспалением и тромбозом. При врождѐнных пороках сердца «бледного типа» (характеризующихся сбросом крови из большого круга кровообращения в малый) спазм мелких ветвей лѐгочной артерии вначале играет положительную роль, предупреждая отѐк лѐгких. Однако одновременно с вазоконстрикцией начинается процесс ремоделирования лѐгочных сосудов, иногда длящийся многие годы. Он охватывает все слои сосудистой стенки и характеризуется пролиферативными и обструктивными изменениями с участием нескольких типов клеток, включая эндотелиальные, гладкомышечные клетки и фибробласты. Также у больных ЛАГ нарушается метаболизм серотонина, лѐгочного вазоконстрикторного вещества, депонированного в тромбоцитах. В итоге происходит тромбоз как микроциркуляторного русла, так и эластических лѐгочных артерий. Изменения артерий малого круга кровообращения становятся необратимыми. Вследствие этого ликвидация дефекта в перегородке сердца либо не облегчает состояния больного, либо приводит к его смерти вследствие неспособности правого желудочка прокачивать кровь через суженные артерии лѐгких.
Диагноз ЛАГ основывается на клинических проявлениях (одышка, акцент 2-го тона на лѐгочной артерии), ЭКГ (отклонение оси сердца вправо у нормостеника), рентгенологических данных (увеличение 2-й дуги, усиление лѐгочного рисунка, увеличение теней правых камер сердца), эхокардиографии (по регургитации на трикуспидальном клапане, ускорению потока в лѐгочной артерии, расширению правых камер сердца – рис. 6) и зондировании полостей сердца.
Рис. 6. ЭХО-КГ (верхушечная четырѐхкамерная позиция) при тяжѐлой лѐгочной гипертензии. Дилатация правых камер сердца: RV – правый желудочек, LV – левый желудочек, RA - правое предсердие, LA – левое предсердие.
Вплоть до настоящего времени отечественные кардиохирурги используют классификацию ЛАГ (см. таблицу ниже), разработанную В.И. Бураковским, Л.Р. Плотниковой и В.А. Бухариным в институте им. А.Н. Бакулева.

12
|
|
|
Таблица |
Классификация легочной гипертензии |
|
|
|
Стадия |
Отношение |
Отношение |
Сброс крови по |
гипертензии |
систолического |
общего лѐгочного |
отношению к |
|
давления в |
сосудистого |
минутному объѐму |
|
лѐгочном стволе к |
сопротивления к |
малого круга |
|
системному |
системному |
кровообращения, %. |
|
артериальному |
|
|
|
давлению |
|
|
1а |
До 30 |
До 30 |
< 30 |
|
|
|
|
1б |
30 |
30 |
>30 |
|
|
|
|
II |
До 70 |
50 -60 |
30 |
|
|
|
|
III а |
> 70 |
< 60 |
> 40 |
|
|
|
|
III6 |
100 |
>60 |
<40 |
|
|
|
|
IV |
100 |
100 |
Справа налево |
|
|
|
|
Классификация направлена на определение тактики лечения больных: при I
– IIIa стадии ЛГ операция дает хороший эффект; при III6 стадии состояние больных не улучшается, а IV стадия ЛГ является противопоказанием к операции.
Вместе с тем, хотя проведение стандартного зондирования полостей сердца с ангиопульмонографией и позволяет установить факт наличия ЛАГ у больных с врождѐнными пороками сердца, оно не дает информации о еѐ обратимости, которая определяет прогноз заболевания в целом. В последнее время с прогностической целью стала применяться серийная радионуклидная ангиопульмонография на фоне фармакологических проб с вазодилататорами. Скоростные параметры прохождения дозы изотопа рассчитывают, выделяя зоны, соответствующие правому, левому желудочку и лѐгким. Затем по выбранным зонам строят графики «активность-время», позволяющие определить время транзита индикатора по сосудам лѐгких. Сопоставляя изменения показателей радионуклидных ангиопульмонограмм, в покое и на фоне действия вазодилататоров, делают вывод о прогнозе течения ЛАГ.
В качестве примера можно привести способ Завадовского К.В и соавторов (2004), использующих в качестве радиофармпрепарата 99mТсдиэтилентриаминопентаацетат, а в качестве вазодилататоров – эналаприалат и нифедипин. При увеличении показателя шунтирования крови на фоне пробы с эналаприлатом >0,1 от исходного и модального артериального времени на фоне пробы с нифедипином >10% прогноз течения лѐгочной гипертензии считают благоприятным, а при одновременном отсутствии изменений данных показателей относительно их исходного значения прогноз течения лѐгочной гипертензии считают неблагоприятным.
13
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
Открытый артериальный проток (ОАП) – сосуд, через который после рождения сохраняется патологическое сообщение между аортой и лѐгочной артерией. Относится к группе пороков бледного типа с усиленным лѐгочным кровотоком.
Частота. 5-10% от всех врождѐнных пороков сердца; у новорождѐнных встречается с частотой 0,88 на 10000 (находится на 9 месте по частоте после ДМЖП, атрезии лѐгочной артерии с интактной межжелудочковой перегородкой, стеноза лѐгочной артерии, атрио-вентрикулярной коммуникации, транспозиции магистральных сосудов, тетрады Фалло, ДМПП, синдрома гипоплазии левого сердца, коарктации аорты). В связи с высокой летальностью больных с комбинированными пороками сердца, частота встречаемости ОАП «в чистом виде» у детей старше 1 года возрастает. В 5-10% случаев ОАП сочетается с другими ВПС. При этом в
некоторых случаях от продолжения функционирования ОАП зависит жизнеспособность больных. В частности, выделяются пороки с лѐгочной дуктус-зависимой гемодинамикой, когда кровь поступает в малый круг кровообращения исключительно по ОАП (транспозиция магистральных сосудов, атрезия лѐгочной артерии или трикуспидального клапана и т.п.) и системной дуктус-зависимой гемодинамикой, когда кровь в большой круг кровообращения поступает по ОАП (синдром гипоплазии левого сердца, критический аортальный стеноз, коарктация аорты, перерыв дуги аорты).
Физиология. Во время внутриутробного развития ОАП служит для шунтирования крови в обход нефункционирующего малого круга кровообращения. После рождения происходит физиологическое закрытие протока. На процесс окклюзии артериального протока влияют прекращение поступления материнского простагландина Е1 (расширяющего проток) и повышение насыщения крови кислородом (спазмирующего проток). Предполагается, что сохранение проходимости протока связано с гипоксией новорождѐнного при патологических родах, приводящей к сохранению фетальной циркуляции.
Анатомия. ОАП располагается в верхнем отделе переднего средостения, прикрыт листком париетальной плевры. Проток отходит от аорты на уровне

14
левой подключичной артерии или несколько ниже еѐ и впадает в основной ствол лѐгочной артерии или в еѐ левую ветвь.
Ширина протока – 5-7 мм, длина – 10-25 мм. ОАП имеет или цилиндрическую форму, или форму усечѐнного конуса.
Гемодинамика. При незаращении артериального протока под влиянием градиента давления между аортой и лѐгочной артерией, часть крови поступает через проток из аорты в лѐгочную артерию и далее в лѐгкие, в левые камеры сердца и аорту. Дополнительный объѐм крови в лѐгких приводит к переполнению его сосудистого русла и повышенной работе левого предсердия и желудочка, вызывая их гипертрофию (рис. 7).
Вследствие большой резервной емкости сосудистого русла лѐгких, даже длительный сброс крови у детей не служит причиной развития лѐгочной гипертензии. Повышение давления в лѐгочной артерии в основном является следствием передачи давления через широкий проток из аорты в лѐгочную артерию. Сброс вызывает объѐмную перегрузку желудочков. Это первая стадия заболевания – стадия первичной адаптации . В этой стадии могут развиться нарушения кровообращения и критическое состояние больных с летальностью около 20%.
Вторая стадия – стадия относительной компенсации, которая обычно наступает в возрасте 2-3 лет и продолжается в первые два десятка лет жизни. Для этой стадии характерно: гиперволемия малого круга, развитие относительного стеноза митрального отверстия, расширение левого предсердия, умеренное повышение давления в лѐгочных венах и в лѐгочной артерии, что вызывает систолическую перегрузку правого желудочка. В результате спазма артериол сосудистое сопротивление или нормальное или может быть несколько повышенным. В дальнейшем наступает перестройка мелких сосудов вплоть до необратимых склеротических изменений. Это стадия вторичных склеротических изменений, при которой на первый план выходят симптомы лѐгочной гипертензии.
Клиника. Клиника ОАП зависит от степени нарушения гемодинамики. Жалобы. В первой стадии – жалоб нет. При нарушенной гемодинамике:
-слабость, быструю утомляемость, одышку при физической нагрузке,
-в старшей возрастной группе – сердцебиение, перебои, боли в сердце.
-Некоторые больные жалуются на носовые кровотечения, осиплость голоса при физической нагрузке.
Объективно:
-дети отстают в физическом развитии, особенно в возрасте старше 3-х лет,
-выявляется деформация грудной клетки в виде "сердечного горба",
-верхушечный толчок смещѐн влево и вниз,
-во II-III межреберьях слева от грудины определяется систолодиастолическое или систолическое дрожание,
-при выраженном нарушении гемодинамики границы сердца расширены вначале за счѐт гипертрофии левого желудочка, а затем и правого,
-пульс быстрый, высокий,
15
-при широком протоке увеличивается пульсовое давление за счѐт снижения диастолического. Особенно это выражено у детей раннего возраста.
Аускультация
-Во II-III межреберьях выслушивается характерный для ОАП систолодиастолический шум. Этот шум проводится на верхушку, основание сердца, сосуды шеи и в межлопаточное пространство. У детей в первые месяцы жизни, а
увзрослых при резко выраженной гипертензии выслушивается только систолический шум.
-Второй тон из-за непрерывного систоло-диастолического шума не выслушивается. При резко выраженном нарушении гемодинамики (гипертензии малого круга) II тон усилен и даже расщеплѐн.
-При сочетании ОАП с ДМЖП в III-IV межреберьях слева от грудины выслушивается грубый систолический шум, иногда он перекрывает систолодиастолический шум артериального протока.
ЭКГ. В первой стадии заболевания ЭКГ не изменена. В последующем
появляются признаки гипертрофии миокарда левого желудочка: глубокий SVIV2 и высокий RV5-V6, интервал ST смещѐн вниз, иногда в левых грудных отведениях зубец Т высокий, остроконечный. При резко выраженной гипертензии лѐгочной артерии появляются симптомы перегрузки правого желудочка.
Рентгенологическое исследование. Лѐгочный рисунок усилен, корни расширены, талия сглажена за счѐт II дуги. Отмечается расширение восходящей аорты. В 1-й косой проекции увеличено левое предсердие. Во 2-й косой проекции увеличен левый желудочек, а при выраженной гипертензии и правый желудочек.
Катетеризация сердца и ангиокардиография. В настоящее время их применяют лишь в сложных клинических случаях при подозрении на сочетанную патологию. Также катетеризация сердца выполняется в запущенных случаях для определения сосудистого лѐгочного резерва. Кроме того, катетеризация сердца – компонент эндоваскулярных вмешательств (имплантации окклюдеров ОАП).
Эхокардиография.
Рис. 8. Эхокардиография – выявление потока сброса через ОАП при помощи непрерывно-волнового допплера (сокращения: ВТПЖ – выводной тракт правого желудочка, ЛА – лѐгочная артерия, Восх.Ао – восходящая аорта).

16
Косвенные признаки ОАП: увеличена полость и утолщены стенки левого желудочка, изменено отношение размера левого предсердия к диаметру аорты. (В норме размеры равны или левое предсердие несколько меньше диаметра аорты.) При допплеровском исследовании находят турбулентный систоло-диастолический поток в лѐгочном стволе (рис. 8).
Дифференциальная диагностика. ОАП необходимо дифференцировать от дефекта аортолѐгочной перегородки, свищей коронарных артерий, аортальной недостаточности, сочетающейся с ДМЖП.
При выраженной лѐгочной гипертензии сохраняется лишь систолический компонент шума ОАП и потому его приходится дифференцировать с ДМПП и ДМЖП.
Лечение При установлении диагноза показания к операции абсолютны. Оптимальный
возраст для операции 2-5 лет. При наличии лѐгочной гипертензии операция показана больным II-IIIа гемодинамических групп (см. главу «Лѐгочная артериальная гипертензия»).
В раннем детском возрасте показанием к операции является сердечная недостаточность, не купирующаяся медикаментозно, гипотрофия, прогрессирующая лѐгочная гипертензия, рецидивирующая пневмония.
Увзрослых больных возраст не должен служить противопоказанием к операции.
Если ОАП осложняется бактериальным эндокардитом и артериитом, операция производится после проведѐнной интенсивной терапии. Медикаментозное лечение ОАП индометацином рекомендуется в первые три дня после рождения в дозе 0,2 мг/кг-сут. Противопоказанием к лечению является: почечная недостаточность, энтероколит, нарушение свертывающей системы крови, билирубинемия свыше 0,1 г/л.
Хирургическое лечение порока заключается в перевязке протока двойной лигатурой, в некоторых случаях с пересечением протока. Эндоваскулярное закрытие ОАП описано ниже.
Интраоперационные осложнения: - травма возвратного нерва,
- кровотечение из поврежденных сосудов, - повреждение грудного лимфатического протока.
Результаты. Послеоперационная летальность - 0-3%. Отдалѐнные результаты зависят от обратимости изменений в сосудистом русле лѐгких (классификацию см. в главе «Лѐгочная артериальная гипертензия»).
Убольных первой и второй гемодинамических групп наступает полное выздоровление.
Убольных IIIа группы полной нормализации гемодинамики не наступает. Операция противопоказана больным III6 и IV гемодинамических групп. Эндоваскулярное закрытие ОАП Для катетеризационного закрытия открытого артериального протока
применяются различные системы. В частности, ОАПы размером менее 4 мм
17
закрывают спиралями ―Flipper‖ фирмы ―Cook‖. Протоки большего размера спиралями не закрывают, так как их имплантация может осложниться дислокацией устройства и эмболией. При ОАПах диаметром от 4 до 10 мм безопаснее использовать окклюдер Amplatzer (схожие по конструкции окклюдеры Сидериса и Рашкинда менее эффективны).
По форме окклюдер Amplatzer, используемый для закрытия ОАП, напоминает гриб (рис. 9). «Шляпка» грибка – аортальный диск – предназначен для закрывания устья протока. «Ножка» грибка устанавливается в просвет протока. Окклюдер сделан из проволоки (сплав никеля с титаном) и заполнен дакроновым волокном. Механические свойства проволоки таковы, что еѐ можно «упаковать» в катетер диаметром 2,5 мм.
При этом материал, из которого сделан окклюдер, имеет «память», т.е. после вытягивания из катетера окклюдер принимает форму, которая была придана ему при производстве.
Рис. 9. Окклюдер Amplatzer, используемый для закрытия ОАП. Процедура имплантации окклюдера
Первоначально производится ангиография. Могут быть применены два способа: 1) проведение ангиографического катетера через бедренную вену в правое предсердие, правый желудочек, лѐгочную артерию и затем, через открытый артериальный проток, в аорту; 2) введение катетера до проксимального отдела нисходящей части дуги аорты через пункционное отверстие на бедренной артерии. Выполняются ангиограммы аорты, открытого артериального протока и лѐгочной артерии. Снимки делаются в двух проекциях. На основании ангиограмм определяется форма и размеры ОАП. Согласно им выбираются размер окклюдера (рекомендуется, чтобы «ножка» окклюдера была на 2 мм шире диаметра ОАП). После ангиографии в аорту из бедренной вены устанавливается проводник, а катетер для ангиографии удаляют. По проводнику в аорту вводится специальная доставляющая система. Еѐ положение проверяется повторной ангиографией. В доставляющей системе находится сложенный окклюдер, привинченный к проволоке-толкателю. Пока доставляющая система находится внутри аорты, из неѐ выдвигается «шляпка» окклюдера. Затем система подтягивается назад, в сторону лѐгочной артерии так, чтобы «шляпка» устройства плотно прилегла к устью ОАП. После этого
освобождается «ножка» окклюдера, закрывающая просвет протока. Вновь производится ангиография.
Если «ножка» окклюдера выступает в просвет левой ветви лѐгочной артерии на 3 мм и более либо если окклюдер перекрывает половину просвета этого сосуда, окклюдер удаляют, втягивая за проволоку в доставляющую систему. Если же положение устройства правильное, проволоку-толкатель отвинчивают от окклюдера и удаляют систему доставки (рис. 10).
Рис. 10. Ангиограмма: окклюдер в просвете ОАП. Доставляющая система удалена.

18
Противопоказания для имплантации окклюдера Amplatzer:
-вес больного менее 6 кг,
-возраст моложе 6 месяцев,
-тромбы в полостях сердца,
-невозможность катетеризации сердца в связи с тромбозом бедренной вены или малым еѐ диаметром,
-не излеченные инфекции (любого характера),
-высокая лѐгочная гипертензия (лѐгочное сосудистое сопротивление более 8 единиц Вуда либо соотношение лѐгочного сосудистого сопротивления к системному сосудистому сопротивлению более 0,4). [Единицами Вуда оценивается лѐгочное сосудистое сопротивление. Они вычисляются путѐм деления давления в лѐгочной артерии на объѐм минутного кровотока в малом круге. Семь единиц Вуда = 8 мм рт. ст./л/мин]
Возможные осложнения Аритмии, излечивающиеся медикаментозно либо путѐм
электроимпульсной терапии (0,5% случаев), частичная обструкция лѐгочной артерии (0,3% случаев), образование тромбов на устройстве (0,3%), образование ложной аневризмы в области сосудистого доступа (0,3%), гематома в паху
(1,7% случаев).
Послеоперационное ведение:
Через 1, 3 и 12 месяцев после процедуры больным проводят контрольную ЭХО-КГ. В течение 6 месяцев больным проводят профилактику эндокардита.
ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
Дефект межпредсердной перегородки (ДМПП) – врождѐнный порок сердца, характеризующийся наличием сообщения в перегородке между предсердиями, через которое происходит сброс крови.
Распространенность: показатель встречаемости этого порока на 10 000 новорождѐнных составляет 2,35. Однако, поскольку после рождения погибают многие больные со сложными, комбинированными пороками сердца, встречаемость ДМПП возрастает до 8-20%. Критические состояния, требующие экстренной помощи, у новорождѐнных с ДМПП возникают в 6,6% случаев.
Анатомическая классификация. Возникновение различных видов ДМПП происходит в первые месяцы эмбриогенеза. Различают дефекты первичной перегородки (на хирургическом жаргоне называемые «первичными») и дефекты вторичной перегородки («вторичные» ДМПП). Хотя термины «первичный» и «вторичный» ДМПП не имеют отношения к срокам образования дефектов, они употребляются в силу устойчивой привычки хирургов. Первичным дефектом называют отсутствие части перегородки медиальнее коронарного синуса вплоть до фиброзного кольца трикуспидального клапана. Он встречается в 10% случаев.
19
Первичные ДМПП часто распространяются на перегородочную створку митрального клапана. Такой порок называется неполной формой атриовентрикулярной коммуникации. Вторичные ДМПП подразделяют на центральные, располагающиеся в области овальной ямки, иногда продолжающиеся вниз до устья нижней полой вены (80% случаев) и дефекты венозного синуса, расположенные в области устья верхней полой вены (10% случаев). Нередко дефекты венозного синуса сочетаются с аномальным впадением правой верхней лѐгочной вены в верхнюю полую вену или правое предсердие. Дефекты могут быть множественными и сочетаться со стенозом лѐгочной артерии, дополнительной верхней полой веной, дефектом межжелудочковой перегородки. В редких случаях межпредсердная перегородка может отсутствовать (общее предсердие).
Нарушение гемодинамики (рис. 11). Основным механизмом нарушения гемодинамики при ДМПП является сброс крови из левого предсердия в правое вследствие разности давления. (Давление в левом предсердии на 5-7 мм рт. ст. выше, чем в правом.) Величина сброса достигает 10-25% от минутного объѐма. Таким образом, артериальная кровь совершает повторный путь через малый круг кровообращения. Каждый миллилитр такой смешанной крови при прохождении через капилляры лѐгких может выделить меньше углекислоты и поглотить меньше кислорода, чем миллилитр венозной крови. Для поддержания необходимого уровня обмена газов правому сердцу в единицу времени приходится проталкивать через лѐгкие больше крови, чем в норме, а возвращаясь в левое предсердие, часть крови вновь уходит через дефект, не принимая участия в газообмене организма. Низкая сопротивляемость системы лѐгочной артерии позволяет проходить такому увеличенному количеству крови. Перерастяжение крупных сосудов лѐгочной артерии приводит к спазму лѐгочных капилляров. Стойкий длительный спазм постепенно приводит к склерозу капиллярного звена лѐгких, и с этого момента
давление в системе лѐгочной артерии начинает нарастать. Правый желудочек, испытывая значительное сопротивление, гипертрофируется. Нарастающее давление в лѐгочной артерии приводит к тому, что и в правом предсердии давление увеличивается. Лево – правый сброс уменьшается, давление выравнивается, шумовая картина исчезает. На следующем этапе наступает обратный сброс крови справа налево. Венозная кровь, попадая в большой круг кровообращения, определяет развитие цианоза. Одновременно с этим, как правило, развивается правожелудочковая недостаточность.
Рис. 11. Схема нарушений гемодинамики при ДМПП.
Жалобы больного зависят от степени нарушения гемодинамики и меняются с возрастом. Многие больные с ДМПП вторичного типа в детстве не предъявляют жалоб. Характерны частые простудные заболевания, пневмонии, часто присоединяется бактериальный эндокардит. С возрастом появляются жалобы на
