
Биохимия_Ответы
.pdf1. Предмет та завдання біологічної хімії. Значення біохімії в системі природничих наук. Зв`язок біохімії з іншими дисциплінами.
Биохимия, как следует из названия (от греческого bias—жизнь),—это химия жизни, или, более строго, наука о химических основах процессов жизнедеятельности.
Структурной единицей живых систем является клетка, поэтому можно дать и другое определение: биохимия как наука изучает химические компоненты живых клеток, а также реакции и процессы, в которых они участвуют.
Задачи биохимии
Главная задача биохимии состоит в том, чтобы достичь полного понимания на молекулярном уровне природы всех химических процессов, связанных с жизнедеятельностью клеток. Для решения этой задачи необходимо выделить из клеток многочисленные соединения, которые там находятся, определить их структуру и установить их функции. А также, понять механизмы развития заболеваний; разработать методы эффективной диагностики заболеваний; создать новые методы лечения заболеваний.
Области исследования
Сфера биохимии столь же широка, как и сама жизнь. Всюду, где существует жизнь, протекают различные химические процессы. Биохимия занимается изучением химических реакций, протекающих в микроорганизмах, растениях, насекомых, рыбах, птицах, низших и высших млекопитающих, и в частности в организме человека. Для студентов, изучающих биомедицинские науки, особый интерес представляют два последних раздела. Однако было бы недальновидно совсем не иметь представления о биохимических особенностях некоторых других форм жизни: нередко эти особенности существенны для понимания разного рода ситуаций, имеющих прямое отношение к человеку.
Биохимия и другие биологические науки
Между биохимией и медициной имеется широкая двусторонняя связь. Благодаря биохимическим исследованиям удалось ответить на многие вопросы, связанные с развитием заболеваний, а изучение причин и хода развития некоторых заболеваний привело к созданию новых областей биохимии, тоесть изучение болезней способствует развитию биохимии. Интенсивное изучение онкогенов в раковых клетках привлекло внимание к молекулярным механизмам контроля роста клеток. Изучение низших организмов и вирусов. Ценная информация, которая оказалась весьма полезной для проведения биохимических исследований в клинике, была получена при изучении некоторых низших организмов и вирусов.
Биохимия нуклеиновых кислот лежит в самой основе генетики; в.свою очередь использование генетических подходов оказалось плодотворным для многих областей биохимии.
Физиология, наука о функционировании организма, очень сильно перекрывается с биохимией. В иммунологии находит применение большое число биохимических методов, и в свою
очередь многие иммунологические подходы широко используются биохимиками.
Фармакология и фармация базируются на биохимии и физиологии; метаболизм большинства лекарств осуществляется в результате соответствующих ферментативных реакций.
Яды влияют на биохимические реакции или процессы; эти вопросы составляют предмет токсикологии. Как мы уже говорили, в основе разных видов патологии лежит нарушение ряда химических процессов. Это обусловливает все более широкое использование биохимических подходов для изучения различных видов патологии (например, воспалительные процессы, повреждения клеток и рак).
Многие из тех, кто занимается зоологией и ботаникой, широко используют в своей работе биохимические подходы.
Эти взаимосвязи не удивительны, поскольку, как мы знаем, жизнь во всех своих проявлениях зависит ог разнообразных биохимических реакций и процессов. Барьеры, существовавшие ранее между биологическими науками, фактически разрушены, и биохимия все в большей степени становится их общим языком.
2.Жиророзчинні вітаміни та їхня роль.
Известно около полутора десятков витаминов. Исходя из растворимости, витамины делят на жирорастворимые — A, D, E, F, K и водорастворимые — все остальные. Жирорастворимые витамины накапливаются в организме, причѐм их депо являются жировая ткань и печень.
Витамин А
Он содержится только в продуктах животного происхождения. В чистом виде это кристаллическое вещество светло-желтого цвета, хорошо растворяется в жире. Неустойчив к действию кислот, ультрафиолету, кислороду воздуха. Витамин А оказывает влияние на развитие молодых организмов, состояние эпителиальной ткани, на процессы роста и формирования скелета, ночное зрение. Витамин А участвует в нормализации состояния и функции биологических мембран.
Особенно витамин А нужен щитовидной железе, печени и надпочечникам. Он один из витаминов, сохраняющих молодость.
Недостаток витамина А широко распространен. Из-за этого происходит замедление реакции организм. Вообще проблема дефицита витамина А остро стоит во всем мире.
Потребность в витамине А составляет 1,5 мг/сутки, что равняется приблизительно 5000 ME (1 ME=0,3 мг), причем не менее 1/3 потребности должно быть удовлетворено за счет самого витамина А, а 2/3 — за счет в-каротина.
Гипервитаминоз витамина А встречается крайне редко, так как нужны необычайно высокие дозы, поступление которых в жизни трудно осуществить.
Уменьшают запасы витамина А алкоголь, канцерогены, висмут; сильное уменьшение в диете белка (с 18 до 3%) уменьшает отложение этого витамина в печени более чем 2 раза.
Важнейшие источники витамина А: печень, сливочное масло, сливки, сыр, яичный желток, рыбий жир. При тепловой обработке витамин А значительно разрушается.
Витамин Д
Известны около семи веществ, обладающих антирахитической активностью, из которых витамин Д наиважнейший. При действии на кожу ультрафиолетовых лучей образуется холекальциферол (витамин Д3) из своего провитамина, содержание которого особенно высоко в коже, обладающей высокой витаминной активностью. В растительных организмах содержится эргостерин, являющийся провитамином Д.
Витамин Д нормализует всасывание из кишечника солей кальция и фосфора, способствует отложению в костях фосфора и фосфата кальция (то есть укрепляет зубы) и препятствует заболеванию рахитом. Имеются также указания на роль витамина Д в определении ряда свойств мембран клетки и субклеточных структур, в частности их проницаемости для ионов кальция и других катионов.
Суточная потребность в витамине Д взрослых людей, детей старше 3 лет, составляет 100 ME, детей до 3 лет — 400 ME.
Высокое содержание витамина Д — в зародышах зерновых, зеленых листьях, пивных дрожжах, рыбьем жире. Богаты им яйца, сливочное масло, молоко. Провитамин Д содержится в белокочанной капусте и в небольшом количестве — в моркови.
Применение с лечебной целью, а также в качестве профилактики витамина Д требует предосторожности: они токсичны.
Витамин Е
Другое название витамина Е — токоферол. По биологическому действию токоферолы делятся на вещества витаминной и антиокислительной активности.
Физиологическое значение заключается в его антитоксическом действии на внутриклеточные липидные (жиры). Окисление внутриклеточных липидов обусловливает образование токсических для клетки веществ из расщепленных ненасыщенных жирных кислот. Они могут привести к нарушению функции клетки и затем к ее гибели. Эти токсические вещества подавляют действие ферментов и витаминов. Витамин Е тесно связан с состоянием и функцией биологических мембран, а также препятствует разрушению эритроцитов. Важнейшим свойством токоферолов является их способность повышать накопление во внутренних органах жирорастворимых витаминов, особенно А.
Токоферолы способствуют активизации процессов синтеза АТФ. Установлена тесная связь токоферолов с функцией и состоянием эндокринных систем, особенно половых желез, гипофиза, надпочечников и щитовидной железы.
Они принимают участие в обмене белка. Достаточный уровень токоферолов способствует развитию мышц и нормализует мышечную деятельность, предотвращая развитие мышечной слабости и утомления. Эта способность широко используется в спортивной медицине как средство нормализации мышечной деятельности в период «ударных» тренировок.
Увеличивает долголетие и функцию размножения. Витамин Е называют токоферолами, от греческого слова toko — потомство и латинского ferre — приносить. Само название говорит о том, что витамин Е играет важную роль в воспроизводительной функции организма. Он способствует нормальному течению беременности и развитию плода, а также активно участвует в процессах образования спермы.
Суточная потребность взрослых в витамине Е примерно 12—15 мг. Им богаты растительные масла, зародыши злаков, зеленые овощи.
Витамин К
К витаминам группы К относятся природные вещества — витамин K1 (филлохинон) и витамин К2 (мелахинон). Свое название витамин К получил от слова «коагуляция» (свертываемость)
Эти витамины участвуют в процессах свертывания крови. Также проявляют анаболитическое действие путем участия в продукции АТФ, что важно в нормальном энергообеспечении организма.
Вообще в витамине К нуждается каждая клетка организма, поскольку он имеет большое значение для сохранения структурных, функциональных свойств клеточных мембран и органелл.
У взрослых витамин К синтезируется микрофлорой кишечника (до 1,5 мг в сутки), поэтому у них возможны вторичные авитаминозы витамина К в кишечнике или вследствие прекращения его синтеза микрофлорой. Наиболее частой причиной авитаминоза К являются болезни печени.
Витамин К содержится в зеленых листьях салата, капусты, крапивы, люцерне. Под влиянием солнечного света зеленые листья растений синтезирут его. Из микроорганизмов кишечного тракта, синтезирующих витамин К, наибольшее значение имеет кишечная палочка, населяющая толстую кишку.
Витамин F
Комплекс полиненасыщенных жирных кислот, которые принимают значительное участие в биологических процессах:
линолевая кислота (омега-6)
линоленовая кислота (омега-3)
арахидоновая кислота (омега-6)
эйкозапентаеновая кислота (омега-3)
докозагексаеновая кислота (омега-3)
Выделяют два семейства полиненасыщенных жирных кислот: омега-3 и омега-6. Жиры от каждой из этих семейств являются существенными, поскольку организм может преобразовать одну омегу-3 в другую омегу-3, например, но не может создать омегу-3 на пустом месте. Биологическое значение витамина F
Витамин F важен для сердечно-сосудистой системы: препятствует развитию атеросклероза, улучшает кровообращение, обладает кардиопротекторным и антиаритмическим действием. Полиненасыщенные жирные кислоты уменьшают воспалительные процессы в организме, улучшают питание тканей
Лучшими натуральными источниками витамина F являются растительные масла из завязи пшеницы, семени льна, подсолнечника, соевых бобов, арахиса, а также грецкий орех, миндаль, семечки подсолнуха, а также рыбы жирных и полужирных сортов (лосось, макрель, сельдь, сардины, форель, тунец и др.) и моллюски.
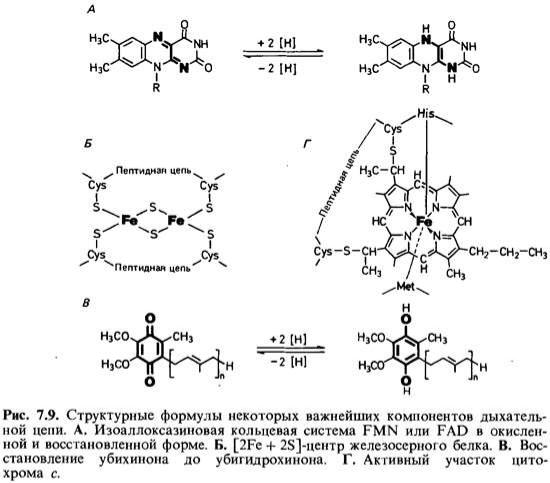
3.Електронтранспортний ланцюг мітохондрій (дихальний ланцюг).
Дыхательная цепь
Дыхательная цепь является частью процесса окислительного фосфорилирования. Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или
восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+ и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической . Большая часть выделяющейся при этом энергии используется для создания градиента протонов и, наконец, для образования АТФ с помощью АТФ-синтазы.
Компоненты дыхательной цепи
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками . К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин , При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
Организация дыхательной цепи
Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H+, т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ
Как уже упоминалось, все комплексы с I по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они не контактируют друг с другом, так как электроны переносятся убихиноном и цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O2 и образование АТФ (ATP). Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство, откуда через порины проникает в цитоплазму.
Метаболические функции
Митохондрии являются «силовой станцией» клетки, поскольку за счет окислительной деградации питательных веществ в них синтезируется большая часть необходимого клетке АТФ (АТР). В митохондриях локализованы следующие метаболические процессы: превращение пирувата в ацетил-КоА, катализируемое пируватдегидрогеназным комплексом: цитратный цикл; дыхательная цепь, сопряженная с синтезом АТФ (сочетание этих процессов носит название «окислительное фосфорилирование»); расщепление жирных кислот путем β-окисления и частично цикл мочевины.
Митохондрии также поставляют клетке продукты промежуточного метаболизма и действуют наряду
сЭР как депо ионов кальция, которое с помощью ионных насосов поддерживает концентрацию Са2+ в цитоплазме на постоянном низком уровне (ниже 1 мкмоль/л).
Главной функцией митохондрий является захват богатых энергией субстратов (жирные кислоты, пируват, углеродный скелет аминокислот) из цитоплазмы и их окислительное расщепление
собразованием СО2 и Н2О, сопряженное с синтезом АТФ.
Реакции цитратного цикла приводят к полному окислению углеродсодержащих соединений (СО2) и образованию восстановительных эквивалентов, главным образом в виде восстановленных коферментов. Большинство этих процессов протекают в матриксе. Ферменты дыхательной цепи, которые реокисляют восстановленные коферменты, локализованы во внутренней мембране митохондрий. В качестве доноров электронов для восстановления кислорода и образования воды используются НАДН и связанный с ферментом ФАДН2. Эта высоко экзергоническая реакция является многоступенчатой и сопряжена с переносом протонов (Н+) через внутреннюю мембрану из матрикса в межмембранное пространство. В результате на внутренней мембране создается электрохимический градиент . В митохондриях электрохимический градиент используется для синтеза АТФ из АДФ (ADP) и неорганического фосфата (Рi) при катализе АТФ-синтазой. Электрохимический градиент является также движущей силой ряда транспортных систем .
Митохондрии являются главными потребителями кислорода в организме. Кислородная недостаточность (гипоксия) как результат недостаточного снабжения крови кислородом (ишемия) является причиной повреждения тканей вплоть до некроза. Первым признаком гипоксии является набухание митохондрий.
4. Білки, сучасне уявлення про їхню будову. Рівні структурної організації. Функції білків.
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Название протеины (от греч. protos – первый, важнейший), по-видимому, болем точно отражает первостепенное биологическое значение этого класса вществ. В наше время, когда абсолютно достоверно установлено, что наследственная информация сосредоточена в молекуле ДНК клеток любых живых организмов, не вызывает сомнения, что только белки являются теми молекулярными инструментами, при помощи которых реализуется генетическая информация. Без белков, в частности ферментов, ДНК не может реплицироваться, не может самовоспроизводиться, т.е. лишена способности передавать генетическую информацию.
При соединении аминокислот в цепочку образуется линейная макромолекула белка.
Практически все белки построены из 20 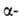 аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями,
аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями,
образованными карбоксильной и  аминогруппами соседних аминокислотных остатков (см. ф-лу I):
аминогруппами соседних аминокислотных остатков (см. ф-лу I):
Белковая молекула может состоять из одной или неск. цепей, содержащих от 50 до неск. сотен (иногда - более тысячи) аминокислотных остатков.
В любом живом организме содержатся тысячи белков, выполняющих разнообразные функции. Чтобы дать представление о многообразии белков, на схеме с увеличением примерно 1 х 1500000 приведен общий вид молекул (с соблюдением формы и размера) ряда вне- и внутриклеточных белков. Функции, выполняемые белками, распределяются примерно следующим образом.
Функции белков
Белки выполняют множество самых разнообразных функций, характерных для живых организмов, с некоторыми из которых мы познакомимся более подробно при дальнейшем изучении курса. Ниже рассматриваются главные и в некотором смысле уникальные биологические функции белков, несвойственные или лишь частично присущие другим классам биополимеров.
Каталитическая функция. К 1995 г. было идентифицировано более 3400 ферментов. Большинство известных в настоящее время ферментов,называемых биологическими катализаторами, является белками. Эта функция белков, хотя и не оказалась уникальной, определяет скорость химических реакций в биологических системах *. * Получены экспериментальные доказательства, что, помимо белков, ферментативной, каталитической активностью наделен и ряд других макромолекул, в частности РНК (названы рибозимами) и моно- и поликлональные антитела (абзимы)
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью,железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности
фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во многих других клетках организма (см. далее). Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода,например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма. Можно назвать еще некоторые другие жизненно важные функции белков. Это, в частности, экспрессия генетической информации, генерирование и передача нервных импульсов, способность поддерживать онкотическое давление в клетках и крови, буферные свойства, поддерживающие физиологическое значение рН внутренней среды, и др.
Таким образом, из этого далеко не полного перечня основных функций белков видно, что указанным биополимерам принадлежит исключительная и разносторонняя роль в живом организме. Если попытаться выделить главное, решающее свойство, которое обеспечивает многогранность биологических функций белков, то следовало бы назвать способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ. В частности, эта высокая специфичность белков (сродство) обеспечивает взаимодействие ферментов с субстратами, антител с антигенами, транспортных белков крови с переносимыми молекулами других веществ и т.д. Это взаимодействие основано на принципе биоспецифического узнавания, завершающегося связыванием фермента с соответствующей молекулой субстрата, что содействует протеканию химической реакции. Высокой специфичностью действия наделены также белки, которые участвуют в таких процессах, как дифференцировка и деление клеток, развитие живых организмов, определяя их биологическую индивидуальность.
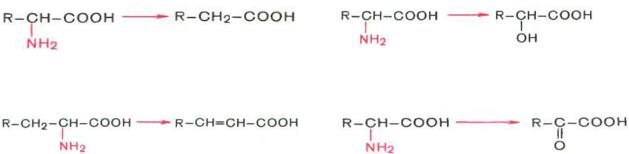
5.Шляхи перетворення та розпаду амінокислот в організмі.
Общие пути превращения аминокислот включают реакции дезаминирования, трансаминирования, декарбоксилирования, биосинтеза и рацемизации.
Дезаминирование аминокислот
Доказано существование 4 типов дезаминирования аминокислот. Во всех случаях NH2-группа
аминокислоты освобождается в виде аммиака. |
|
Восстановительное дезаминирование |
Гидролитическое дезаминирование |
Внутримолекулярное дезаминирование |
Окислительное дезаминирование |
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гистидина, подвергающегося внутримолекулярному дезаминированию.
Кроме перечисленных четырех типов реакций и катализирующих их ферментов в животных тканях и печени человека открыты также три специфических фермента (серин- и треониндегидратазы и цистатионин-γ- лиаза), катализирующих неокислительное дезаминирование серина, треонина и цистеина. Они требуют присутствия пиридоксаль-фосфата в качестве кофермента. Конечными продуктами реакции являются пируват и α- кетобутират, аммиак и сероводород.
Трансаминирование – реакции межмолекулярного переноса аминогруппы (NH2) от аминокислоты на α-кетокислоту без промежуточного образования аммиака (глутамат+ пируват = α- кетоглутарат + аланин). Впервые эти реакции были открыты в 1937г. А.Е. Браунштейном и М.Г. Крицман. Реакции трансаминирования являются обратимыми и универсальными для всех живых организмов, они протекают при участии специфических ферментов – аминотрансфераз (трансамниназ). Теоретически реакции возможны между любой амино- и кетокислотой, но наиболее интенсивно они протекают, если один из партнеров представлен дикарбоновой аминоили кетокислотой. В переносе амниогруппы активное участие принимает кофермет трансминаз – пиридоксальфосфат (производное витамина В6). Для реакций трансаминирования характерен общий механизм. Ферменты реакции катализируют перенос аминогруппы не на α -кетокислоту, а на кофермент; образовавшееся промежуточное соединение (шиффово основание) подвергается внутримолекулярным превращениям, приводящим к освобождению α-кетокислоты и пиридоксамнофосфата. Последний на втолрой стадии реагирует с любой другой α-кетокислотой, что через те же стадии приводит к синтезу новой аминокислоты и пиридоксальфосфата.
Декарбоксилирование - отщепление карбоксильной группы в виде СО2, образующиеся продукты реакции называются биогенными аминами, они оказывают сильное фармакологическое действие на множество функций. Эти реакции являются необратимыми, они катализируютя специфическими ферментами – декарбоксилазами аминокмлоткоторые в качестве кофермента содержат пиридоксальфосфат ( кроме гистидиндекарбоксилазы и аденозилдекарбоксилазы – содержат остаток пировиноградной кислоты в качестве кофермента). В живых организмах открыты четыре типа декарбоксилирования аминокислот. α-декарбоксилирование – характерно для тканей животных: от аминокислот отщепляется соседняя от α-углеродного атома карбоксильная группа. ω- декарбоксилированиесвойственно микроорганизмам декарбоксилирование, связанное с реакцией трансаминирования. Образуется альдегид и новая аминокислота, соответствующая исходной кетокислоте.
6. Перетворення ліпідів. Розщеплення ліпідів у клітині. Процеси окислення жирних кислот.
Липиды - общее название для всех известных жиров и жироподобных веществ с различной структурой, но общими свойствами (нерастворимость в воде, экстракция неорганическими растворителями). Липид (греч. жирный).
В организме человека 10-20 % жиров от массы тела.
Внутриклеточный гидролиз липидов.
Источником жирных кислот, которые подвергаются окислению в тканях высших животных служит либо внеклеточная жидкость, либо эндогенные внутриклеточные липиды. В мышечной ткани, в том числе и в сердечной мышце, жирные кислоты подвергаются непосредственному окислению. Главный источник эндогенных жирных кислот - резервный жир, содержащийся в цитоплазме. Жирные кислоты сначала гидролизуются при помощи специфических внутриклеточных ферментов липаз до глицерина и свободных жирных кислот, а последние подвергаются активации и окислении. Другой источник жирных кислот - фосфоглицериды мембран. Постоянно происходит метаболическое обновление фосфоглицеридов, в процессе которого образуются свободные жирные кислоты.
Расщепление жиров.
Расщепление жиров происходит у человека преимущественно в верхних отделах тонкого кишечника, где имеются условия для эмульгирования жиров. Наиболее мощное эмульгирующее действие на жиры оказывают соли желчных кислот, поступающие в двенадцатиперстную кишку с желчью в виде натриевых солей. Желчные кислоты представляют собой конечный продукт обмена холестерина. По своей химической природе желчные кислоты являются производными холановой кислоты. Желчные кислоты присутствуют в желчи в конъюгированной форме. Эти соединения иногда называют парными, т.к. они состоят из двух компонентов = из желчной кислоты и глицина и из желчной кислоты и таурина. Соли желчных кислот уменьшают поверхностное натяжение на поверхности жир - вода. Желчные кислоты выполняют также важную роль в качестве активатора панкреатической липазы, под влиянием которой происходит расщепление жира в кишечнике. Вырабатываемая поджелудочной железой липаза расщепляет триглицериды, находящиеся в эмульгированном состоянии. В расщеплении жиров участвует также кишечная липаза, она катализирует гидролитическое расщепление моноглицеридов и не действует на ди- и триглицериды. Таким образом, в тонком кишечнике основная часть жира всасывается после расщепления на жирные кислоты и глицерин, которые будучи хорошо растворимыми в воде всасываются в кишечнике, а потом поступают в кровь воротной вены и оттуда в печень. Жирные кислоты с длинной цепью и моноглицериды всасываются при участии желчи (желчных кислот). Жирные кислоты и моноглицериды образуют устойчивые в водной среде мицеллы. Главным эндогенным источником жирных кислот служит резервный жир. Триглицериды жировых депо выполняют в обмене липидов такую же роль, как гликоген печени в обмене углеводов. В качестве источников энергии могут использоваться только свободные жирные кислоты и триглицериды должны гидролизоваться при помощи липаз до глицерина и свободных жирных кислот.
Процесс окисления жирных кислот складывается из следующих этапов: 1 этап - активация жирных кислот и их проникновение из цитоплазмы в митохондрии, при этом происходит образование ацил-КоА. Включает 3 стадии:
а) ферментативная этерификация свободной жирной кислоты цитоплазматическим КоА (за счет энергии АТФ) в наружной мембране митохондрий;
б) перенос остатка жирной кислоты от КоА на молекулу карнитина, при помощи которого
осуществляется транспортировка этого остатка |
через внутреннюю мембрану митохондрий; |
в) перенос остатка жирной кислоты от |
карнитина на внутримитохондриальный КоА. |
2 этап - первая стадия дегидрирования:. При окислении жирных кислот, протекает вслед за стадией активации, происходит внутри митохондрий. Ацил-КоА подвергается ферментативному дегидрированию, превращаясь в КоА эфир ненасыщенной кислоты.
3этап - стадия гидратации: присоединение молекулы воды и образование - гидрооксил КоА. 4этап - вторая стадия дегидрирования, образуется - кетоацил КоА.
5этап - тиолазная реакция: в ней образуется ацетил КоА, который подвергается окисления в цикле Кребса, и ацил КоА, далее проходящий путь окисления.
7. Методи виділення та класифікація білків. Характеристика найважливіших груп простих та складних білків.
Согласно старой классификации, обширный класс белковых веществ в зависимости от химического состава делят на простые и сложные белки.
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты.
Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп: протамины, гистоны, альбумины, глобулины, проламины, глютелины и др. Классификация сложных белков основана на химической природе входящего в их состав небелкового компонента. В соответствии с этим различают фосфопротеины (содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты), нуклеопротеины (содержат нуклеиновые кислоты), гликопротеины(содержат углеводы), липопротеины (содержат липиды) и металлопротеины (содержат металлы).
Простые белки
Протамины и гистоны. Данная группа белков отличается рядом характерных физикохимических свойств, своеобразием аминокислотного состава и представлена в основном белками с небольшой молекулярной массой. Протамины хорошо растворимы в воде, изоэлектрическая точка их водных растворов находится в щелочной среде.
Гистоны также являются белками основного характера. В их состав входят лизин и аргинин, содержание которых, однако, не превышает 20–30%. Молекулярная масса гистонов намного больше нижнего предела молекулярной массы белков. Эти белки сосредоточены в основном в ядрах клеток в составе дезоксирибонуклеопротеинов и играют важную роль в регуляции экспрессии генов .
Проламины и глютелины. Это белки растительного происхождения, отличаются своеобразием аминокислотного состава и физико-химических свойств. Они содержатся в основном в семенах злаков (пшеница, рожь, ячмень и др.), составляя основную массу клейковины. Характерной особенностью проламинов является растворимость в 60–80% водном растворе этанола, в то время как все остальные простые белки в этих условиях обычно выпадают в осадок.
Альбумины и глобулины. Эти белки относятся к белкам, широко распространенным в органах
итканях животных. Наиболее богаты ими белки сыворотки крови, молока, яичный белок, мышцы и др. В плазме крови человека в норме содержится около 7% белков, представленных преимущественно альбуминами и глобулинами. Альбумины и глобулины – это глобулярные белки, различающиеся по растворимости
Сложные белки
Хромопротеины (от греч. chroma – краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеины наделены рядом уникальных биологических функций: они участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез, дыхание клеток
ицелостного организма, транспорт кислорода и диоксида углерода, окислительновосстановительные реакции, свето- и цветовосприятие и др.
Кгруппе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний)порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций.
Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми производными – окисленными флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД). Флавопротеины входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке. Некоторые Флавопротеины содержат ионы металлов. Типичными представителями флавопротеинов, содержащих также негемовое железо, являются ксантиноксидаза, альдегидоксидаза, СДГ,
дигидрооротатдегидрогеназа, |
ацил-КоА-дегидрогеназа |
и |
транспортирующий |
электроны |
