- •Ступко т.В.
- •Введение Общие методические рекомендации
- •1. Основные понятия химии1 Примеры решения задач
- •Задачи для решения на занятии.
- •Задания для самостоятельного решения
- •Тестовые задания
- •Строение вещества2 Примеры решения задач
- •Задания для самостоятельного решения
- •Идз5«Строение атома и химическая связь»
- •Вопросы к коллоквиуму по теме «Строение атома и периодический закон д.И.Менделеева»
- •Пример тестового задания «Строение атома и химическая связь»6
- •3.Учение о химическом процессе
- •3.1. Элементы химической термодинамики7 Примеры решения задач
- •Задачи для решения на занятии.
- •Задачи для самостоятельного решения. Вариант №1
- •Тест «Термодинамика»
- •Кинетика. Химическое равновесие. Примеры решения задач
- •Задания для решения на занятии
- •Задания для самостоятельного решения Вариант №1
- •4. Химические процессы в растворах
- •4.1.Основные понятия о растворах. Равновесия в растворах8 Примеры решения задач
- •Задачи для решения на занятиях
- •Задачи для самостоятельного решения «Способы выражения концентрации растворов»
- •Задачи для самостоятельного решения «Равновесия в растворах»
- •4.2 Окислительно-восстановительные процессы9 Примеры решения задач
- •Задачи для решения на занятиях
- •Задачи для самостоятельного решения
- •Идз «растворы, овр»
- •Приложение
- •Соотношения между значениями физических единиц энергии
- •Соотношения между значениями физических единиц длины
- •Значения фундаментальных физических постоянных
- •Константы диссоциации некоторых кислот и оснований
- •Произведение растворимости малорастворимых электролитов при 25°с
- •Термодинамические характеристики некоторых веществ при 289 к
- •Стандартные электродные потенциалы при температуре 298 к
- •Общие константы образования некоторых комплексов (водный раствор, 25 °с)
- •Содержание
- •1Теоретическая часть в методическом пособии «Основы общей и неорганической химии» Часть I. С.6-29.
Строение вещества2 Примеры решения задач
Пример 1. Вычислите массу фотона, отвечающего длине волны 589 10-9 м. Выразите энергию этого фотона в джоулях. Какова его энергия в килоджоулях на моль?
Решение.
Уравнение
де Бройля связывает длину волны частицы
с его массой и скоростью:
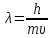 , тогда масса фотона
, тогда масса фотона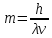 .
.
υ ‑ cкорость фотона (скорость света) равна, h ‑ постоянная Планка, равна 6,625·10-34 Дж.с.
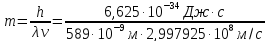 .
= 0,00375.10-33
кг
.
= 0,00375.10-33
кг
Уравнение
Планка связывает длину волны фотона и
его энергию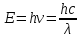 .
.
Энергия 1 фотона равна:
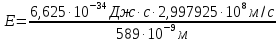 = 0,0337.
10-17
Дж
= 0,0337.
10-17
Дж
Для пересчета на моль фотонов, умножаем это значение на число Авогадро (No = 6•1023моль-1).
0,0337 10-17 Дж•6.1023 моль-1 = 0,202 .105Дж/моль = 20,2 кДж/моль.
Пример 2. Какова погрешность в определении координаты электрона Δх, движущегося в атоме со скоростью υх = 2,0 107 м/с, если погрешность в определении его скорости Δυх, составляет 2%? Сравните полученный результат с размерами атомов и радиусом электрона (re = 2,82 10-15 м).
Решение.Запишем
соотношение неопределенности Гейзенберга:
Δрх.Δх≥
h/4π. Так как Δрх
= тe
Δυх,
где
тe
= 9,11.10-31
кг ‑ масса электрона. Отсюда получаем:
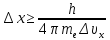 .
.
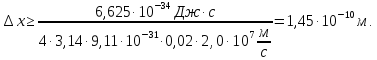 Неопределенность
в координате электрона Ьх больше размера
самого электрона и радиусов ядер на 4,
5 порядков!
При высокой точности определения
скорости Неопределенность в координате
электрона сравнима с размерами атомов.
Следовательно, нахождение электрона в
атоме имеет вероятностный характер.
Неопределенность
в координате электрона Ьх больше размера
самого электрона и радиусов ядер на 4,
5 порядков!
При высокой точности определения
скорости Неопределенность в координате
электрона сравнима с размерами атомов.
Следовательно, нахождение электрона в
атоме имеет вероятностный характер.
Пример 3. Изобразите электронную конфигурацию атома V и иона V3+ в основном состоянии. Для валентных электронов атома ванадия укажите все квантовые числа.
Решение. У атома V 23 электрона и согласно принципу наименьшей энергии и принципу Паули электронная конфигурация ванадия 1s22s22p63s33p64s23d3(или в сокращенной форме [Аr] 4s23d3).
Для иона V3+ электронная конфигурация [Ar]3d2, так как 4s-электроны имеют меньшую энергию3и первыми удаляются в процессе ионизации.
Валентными электронами атома ванадия являются 4s23d3 электроны. Электронно-графическая формула валентного уровня:


4s 3d
Квантовые числа для этих электронов следующие:
|
Квантовое число |
4s2 |
3d3 | ||||
|
1 |
2 |
1 |
2 |
3 | ||
|
n |
4 |
4 |
3 |
3 |
3 | |
|
l |
0 |
0 |
1 |
1 |
1 | |
|
ml |
0 |
0 |
+1 |
0 |
-1 | |
|
s |
+1/2 |
-1/2 |
+1/2 |
+1/2 |
+1/2 | |
Пример 4. Распределите молекулы S2, MgO, НF, СО в порядке возрастания полярности связи.
Решение. Мерой полярности связи является разница в значениях электроотрицательности (ЭО) атомов, образующих связь: ΔЭОS-S= 0; ΔЭОMg-O=3,5–1,2=2,3; ΔЭОH-F=4,0-2,1=1,9, ΔЭОC-O=3,5-2,5=1,0. Следовательно, молекулы будут распределяться в порядке возрастания полярности связи следующим образом: S2 СО, НF, MgO.
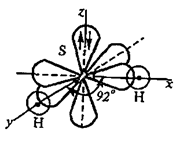
Пример 5. Определите пространственную структуру молекулы H2S. Почему валентный угол чуть больше 90o?
Решение. Ковалентные связи в молекуле Н2S образуются перекрыванием двух р-орбиталей атома серы с двумя s-орбиталями двух атомов водорода (рис.1). Вследствие пространственной ориентации р-орбиталей атома серы, молекула H2S имеет угловую структуру. Из-за незначительного размера атома серы (по сравнению с аналогами ‑ селеном и теллуром) области повышенной электронной плотности сильнее отталкиваются и угол увеличивается.
|
H 1s1 H 1s1
|
|
Рис. 1. Пространственная структура молекулы H2S
Пример 6. Одинаковая ли полярность молекул гидрида сурьмы (III) SbH3 и гидрида бора ВН3?
Решение. Для оценки полярности молекулы используют величину электрического момента диполя молекулы μм равную векторной (геометрической) сумме электрических моментов диполей всех связей (и неподеленных электронных пар). У неполярных молекул эта сумма равна нулю (μм = 0), у полярных молекул она больше нуля (μм > 0). Связи в молекуле SbH3 образуются перекрыванием трех р-орбиталей атома сурьмы(5s25p3) с тремя s-орбиталями трех атомов водорода (1s1). Поскольку р-облака ориентированы в трех взаимно перпендикулярных направлениях (по осям х, у, z), то связи в образовавшейся, молекуле SbH3 направлены от вершины тригональной пирамиды, в которой находится атом сурьмы, к ее основанию, в вершинах которого находятся атомы водорода. Следовательно, молекула SbH3 имеет пирамидальную структуру. Сумма векторов моментов диполей всех связей в молекуле SbH3 не равна нулю, и следовательно, молекула в целом полярна (рис.2).

Рис. 2. Пространственная структура молекул SbH3 и BH3
Ковалентные полярные связи в молекуле ВН3 образуются перекрыванием трех sp2-гибридных орбиталей атома бора (2s22р1) с s-орбиталями трех атомов водорода. Гибридные связи направлены под углом 1200. Ядра всех взаимодействующих атомов лежат в одной плоскости. Молекула имеет форму плоского треугольника. Векторная сумма электрических моментов диполей связей в молекуле равна нулю, следовательно, молекула ВН3 неполярна.
Пример 7. Вычислите дипольный момент молекулы НI, если длина диполя равна 0,09.10-10 м.
Решение. Дипольный момент молекулы равен произведению длины диполя l на величину элементарного электрического заряда g=1,602 10-19 Кл.
μ=gl=1,602.10-19•0,09.10-10 =1,44.10-30 Кл.м = 0,43 D4
Пример 8. Выберите изоэлектронные частицы из ряда С2 , F-, OH- , O2- , CO, N3- , Cl-, HS-, S2-, K, BN, C, N2.
Решение.Изоэлектронными являются частицы (атомы, молекулы, ионы) с одинаковым количеством электронов. Рассмотрим наш пример:
|
Частица |
Электроная формула атомов, ее образующих |
Количество электронов в частице |
|
С2 |
С 1s22s22p2 |
12 |
|
F- |
F 1s22s22p5 F- 1s22s22p6 |
10 |
|
OH- |
O 1s22s22p4 H 1s1 |
10 |
|
O2- |
O 1s22s22p4 O2- 1s22s22p6 |
10 |
|
CO |
С 1s22s22p2 O 1s22s22p4 |
14 |
|
N3- |
N 1s22s22p3 N3- 1s22s22p6 |
10 |
|
Cl- |
Cl 1s22s22p63s23p5 Cl- 1s22s22p63s23p6 |
18 |
|
HS- |
H 1s1 S 1s22s22p63s23p4 |
18 |
|
S2- |
S 1s22s22p63s23p4 S2- 1s22s22p63s23p6 |
18 |
|
K |
K 1s22s22p63s23p64s2 |
20 |
|
BN |
B1s22s22p1 N 1s22s22p3 |
12 |
|
C |
С 1s22s22p2 |
6 |
|
N2 |
N 1s22s22p3 |
14 |
Изоэлектронными являются: F-, OH- и O2-; BN и С2; CO и N2; Cl-; HS-и S2-.

 S
[Ne]3s23p4
S
[Ne]3s23p4