
- •2) Экстенсивті және интенсивті қасиеттер. Термдік және калориялық қасиеттер.
- •59) 1-Ші текті фазалық ауысымдар. Клапейрон-Клаузиус теңдеуі.
- •10) Идеал газдың қоспасы. Дальтон, Амага заңдары. Қоспаның калориялық қасиеттері.
- •51) Метастабилдік күйлер - өте суытылған бу, өте қыздырылған сұйық, созылған сұйық.
- •18) Термодинамикалық потенциалдар u, h, f, g және олардың іргелі теңдеулері
- •Внутренняя энергия
- •26) Нақты газдың күй теңдеулері.
- •35) Термодинамикалық ұқсастық. Сәйкестік күйлер.
2) Экстенсивті және интенсивті қасиеттер. Термдік және калориялық қасиеттер.
Параметры состояния – любая величина, присущая телу, изменение которой определяется только начальным и конечным состоянием тела и не зависит от характера процесса изменения его состояния, при переходе его из первого состояния во второе. Параметры можно разделить на две группы:
Интенсивные – которые не зависят от количества вещества и при взаимодейтсвии тел выравниваются (температура, давление и т.п.);
Экстенсивные – зависящие от количества вещества, следующие закону сложения или, как говорят математики, закону аддитивности (масса, обьем, внутренняя энергия и т.п.).
Измерение экстенсивной величины производится сравнением ее с такой же по природе величиной, выбранной за единицу – эталон (метр, килограмм и т.п.). Измерение интенсивной величины основано на использовании объективной связи между изменениями этой интенсивной величины и какой-либо экстенсивной величины. Например, связь температуры и объема жидкости в термометре приводит к измерению температуры с помощью длины столбика жидкости в термометре.
Некоторые экстенсивные величины приобретают свойства интенсивных, если их рассматривают применительно к единице массы данного вещества (удельные объем, энтальпия и т.п.).
Все термодинамические параметры введены человеком для удобства изучения окружающего мира. Однако не все параметры поддаются измерению приборами. Ряд параметров, не поддающихся измерению, человек ввел для удобства расчета термодинамических процессов. Эти параметры получаются расчетным путем и имеют в размерности величину работы (энергии) Дж или кал. Например, к ним относятся энтальпия и энтропия. Такие параметры получили название – энергетических или калорических параметров, или функций состояния. Параметры, которые возможно измерить приборами, называются термическими. Например, к этим параметрам относятся температура и давление.
Состояние вещества определяется парамтрами состояния,которые разделяются на термические и калорические .
Термические
величины: давление р,
объем
V,
температура
Т,
термические
коэффициенты
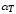 ,
,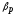 ,
, ;
;
 -
коэффициент изотермической сжимаемости,
-
коэффициент изотермической сжимаемости,
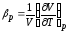 -
коэффициент объемного расширения,
-
коэффициент объемного расширения,
 -
термический коэффициент давления,
-
термический коэффициент давления,
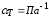 ,
,
 ,
, .
.
Калорические
величины: внутренняя энергия U,
энтропия
S,
энтальпия
H,
свободная
энергия
F,
потенциал
Гиббса G,
теплоемкость
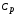 или
или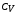 .
.
Уравнение
состояния описывает равновесное
состояние системы. Термические уравнение
- в качестве одного из параметров
состояния входит температура:
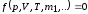 .
.
Калорическое
уравнение - в качестве одного из
параметров входит внутренняя энергия:
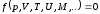 .
.
59) 1-Ші текті фазалық ауысымдар. Клапейрон-Клаузиус теңдеуі.
Экспериментальные данные при фазовых переходах первого рода :
1)
скачком изменяется удельный объем
 или плотность
или плотность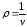 ,
,
2)
скачком изменяется s,
то
есть
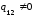 ,
то есть необходима затрата теплоты
фазового перехода,
,
то есть необходима затрата теплоты
фазового перехода,
3) возможны метастабильные состояния.
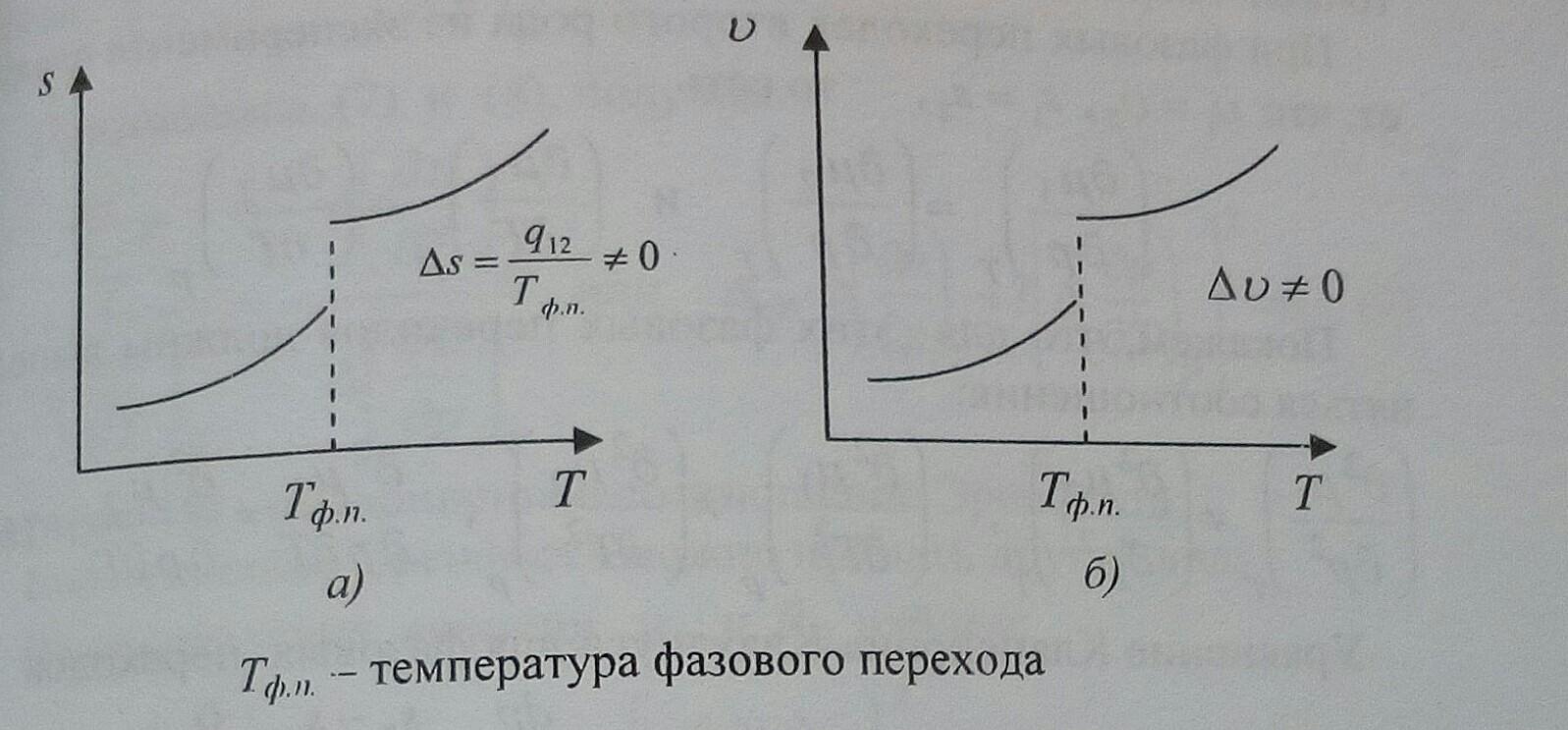
Рис. 1
Примеры: все переходы из одного агрегатного состояния в другое, многие переходы из одних кристаллических модификаций в другие , переход сверхпроводника в несверхпроводящее состояние в магнитном поле и другие.
Так
как
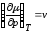 ,
,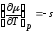 ,
из эксперимента следует, что
,
из эксперимента следует, что
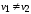 ,
,
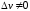 ,
т.е.
,
т.е.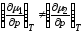 ,
,
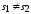 ,
,
 ,
т.е.
,
т.е. ,
,
в соответствии с классификацией Эренфеста см. рис. 1.
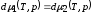
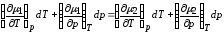 .
.
Отсюда
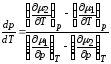 .
(1)
.
(1)
Так
как
 ,
то
,
то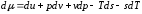 .
.
Здесь u, v, s - удельные величины.
Используем
термодинамическое тождество:
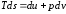 .
.
Отсюда
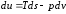 .
.
Тогда
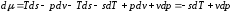 и
и
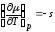 ,
,
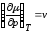 .
.
Тогда
из (1) получим:

Здесь s1 и s2 - удельные энтропии второй и первой фаз,
v1 и v2 - удельные объемы второй и первой фаз.
Это уравнение Клапейрона - Клаузиуса.
