
- •Реакції катіонів першої аналітичної групи
- •1. Дія натрій гідрогентартрату NaНс4н4о6
- •2.Дія винної кислоти h2c4h4o6
- •3. Дія натрій гексанітрокобальтату (III) Na3[Со(nо2)6]
- •4. Мікрокристалоскопічна реакція
- •5. Реакція забарвлення полум'я солями Калію
- •1. Дія калій гексагідроксостибату(V) к[Sb(он)6]
- •2. Мікрокристалоскопічна реакція. Дія цинк триураніл октаацетату Zn(uo2)3(сн3соо)8.
- •Контрольна задача. Аналіз суміші катіонів першої аналітичної групи.
- •Реакції катіонів другої аналітичної групи
- •1. Дія 2м розчину хлоридної кислоти
- •2. Дія розчинів лугів
- •3. Дія розчину амоніаку
- •4. Дія розчину калій хромату к2СrО4
- •5. Дія розчину калій іодиду
- •8. Дія натрій гідроген фосфату(V) (Na2hpo4).
- •9. Дія калій гексаціаноферрату (ііі) (k3[Fe(cn)6]).
- •10. Дія натрій тіосульфату (Na2s2o3).
- •11. Дія натрій сульфіду (Na2s).
- •12. Дія розчинних карбонатів (МехСо3).
- •Контрольна задача. Аналіз суміші катіонів другої аналітичної групи
- •1. Осадження хлоридів катіонів II групи
- •Реакції катіонів третьої аналітичної групи
- •1. Дія 1м розчину сульфатної кислоти
- •2. Дія карбонатів
- •3. Дія хроматів
- •4. Дія насичених розчинів амоній сульфату і амоній оксалату
- •6. Реакція забарвлення полум'я солями Барію, Стронцію, Кальцію
- •8. Реакція з динатрій гідрогенфосфатом Na2hpo4.
- •Контрольна задача. Аналіз суміші катіонів третьої аналітичної групи
- •2. Відокремлення йонів стронцію і кальцію
- •3. Виявлення і відокремлення йонів стронцію
- •4. Виявлення йонів кальцію
- •Лабораторна робота 4. Аналіз суміші катіонів першої, другої та третьої аналітичних груп
- •Аналіз розчину без осаду
- •2. Виявлення катіонів калію.
- •3. Виявлення катіонів натрію.
- •4. Проба па наявність у розчині катіонів II аналітичної групи та їх відокремлення.
- •5. Виявлення катіонів II аналітичної групи.
- •6. Проба на наявність у розчині катіонів III аналітичної групи та їх відокремлення.
- •7. Відокремлення плюмбум (II) сульфату.
- •8. Переведення сульфатів III аналітичної групи в карбонати.
- •9. Розчинення осаду карбонатів та виявлення катіонів III аналітичної групи.
- •Аналіз розчину з осадом
- •2. Відокремлення катіонів II і III аналітичних груп.
- •3. Виявлення і відокремлення плюмбум (іі)-катіонів.
- •4. Виявлення димеркурій (і)-катіопів.
- •5. Виявлення аргентум (і)-катіопів.
- •7. Виявлення катіонів ііі аналітичної групи.
- •8. Виявлення натрій- і калій-катіонів.
- •Реакції катіонів четвертої аналітичної групи
- •1.Дія алізарину
- •2. Дія кобальт (II) нітрату
- •3. Реакція з натрій ацетатом ch3cooNa.
- •4. Реакція з натрій тіосульфатом Na2s2o3.
- •3. Окиснення сполук хрому (VI) до СrO5
- •1.Дія гідроген сульфіду н2s
- •2. Дія розчину калій гексаціаноферату (II) к4[Fе(сn)6]
- •3. Дія дитизону
- •4. Реакція сухим способом з солями Кобальту (іі).
- •Реакції сполук Арсену (Обережно! Сполуки Арсену отруйні)
- •1.Реакція відновлення арсену (iiі) і арсену (V) до АsН3
- •2. Реакція окиспепня сполук Аs(ііі)
- •3. Реакція відновлення сполук арсену (V)
- •Реакції стануму (II) та стануму (IV)
- •1. Реакція з гідроген сульфідом
- •2. Реакція окиснення стануму (II) солями бісмуту (III)
- •3. Реакції відновлення стануму (IV) до стануму (II)
- •4. Виявлення йонів СгО42– і АsО43–
- •Реакції катіонів п'ятої аналітичної групи
- •1. Дія розчину калій гексаціаноферату (III) к3[Fе(сn)6]
- •3. Реакція з диметилгліоксимом (реактивом Чугаєва).
- •1. Дія розчину калій гексаціаноферату (II) к4[Fе(сn)6]
- •2. Дія розчину амоній тіоціанату nн4sсn
- •3. Реакція з натрій ацетатом ch3cooNa.
- •4. Реакція з калій йодидом ki.
- •5. Дія натрій тіосульфату Na2s2o3
- •1. Дія розчину дії натрій гідрогенфосфату Na2hро4
- •4. Реакція з калій гексаціаноферратом(ііі) k3[Fe(cn)6].
- •1. Дія калій іодиду
- •2. Дія свіжоприготовлеіюго розчину натрій тригідроксостапату (II)Na[Sп(он)3]
- •3. Реакція гідролізу.
- •4. Реакція з сульфідами.
- •5. Реакція з тіосечовиною cs(nh2)2 або тіоціанатами.
- •Реакції стибію (III) і стибію (V)
- •1. Дія натрій тіосульфату Na2s2o3
- •2. Відновлення стибію (III) і стибію (V) до металевого стибію
- •Контрольна задача. Аналіз суміші катіонів п'ятої аналітичної групи
- •2. Осадження основних солей Бісмуту і Стибію
- •3. Відокремлення та виявлення стибію (iiі)
- •4. Виявлення бісмут (III)- катіонів
- •5. Відокремлення манган (II), ферум (II, iiі)-, магній- катіонів
- •Реакції катіонів шостої аналітичної групи
- •1. Дія розчинів лугів
- •2. Дія розчину амоніаку
- •3. Дія гідроген сульфіду
- •1. Дія амоніаку
- •2. Дія калій гексаціаноферату (II) к4[Fе(сn)6]
- •3. Дія натрій тіосульфату Nа2s2о3
- •4. Дія калій тіоціанату (kscn).
- •5. Дія металів, що більш активні за мідь (Fe, Zn, Al).
- •6. Дія калій йодиду (ki).
- •6. Дія розчинних карбонатів (МехСо3).
- •1. Дія амоній тіоціанату nн4sсn
- •3. Реакція сухим способом
- •4. Дія натрій гідроген фосфату(V) (Na2hpo4).
- •5. Дія калій гексаціаноферрату (ііі) (k3[Fe(cn)6]).
- •1. Реакція з диметилгліоксимом (реактивом Чугаєва)
- •2. Дія натрій гідроген фосфату(V) (Na2hpo4).
- •4. Дія амоній тіоціанату (nh4scn).
- •5. Дія калій хромату (k2CrO4).
- •6. Дія розчинних карбонатів (МехCo3).
- •7. Дія дифенілкарбазиду (або дифенілкарбазону).
- •1. Реакція з гідроген сульфідом н2s
- •2. Реакція з дифенілкарбазидом
- •3. Реакція з розчином амоніаку і калій йодидом.
- •Контрольна задача. Аналіз суміші катіонів шостої аналітичної групи
- •Лабораторна робота 8. Аналіз суміші катіонів четвертої-шостої алітичних груп
- •1. Попередні дослідження.
- •2. Відокремлення катіонів четвертої аналітичної групи.
- •3. Аналіз суміші катіонів четвертої аналітичної групи.
- •4. Відокремлення катіонів п'ятої аналітичної групи.
- •5. Аналіз суміші катіонів п’ятої аналітичної групи.
- •6. Аналіз суміші катіонів шостої аналітичної групи.
- •Лабораторна робота 9. Аналіз суміші катіонів першої-шостої аналітичних груп
- •1. Попередні спостереження та дослідження.
- •Аналіз суміші катіонів першої-шостої аналітичних груп без осаду
- •2. Відокремлення та виявлення катіонів другої аналітичної групи.
- •3. Відокремлення та виявлення катіонів третьої аналітичної групи.
- •5. Відокремлення та аналіз катіонів IV аналітичної групи.
- •6. Відокремлення катіонів V аналітичної групи.
- •7. Аналіз суміші катіонів V аналітичної групи.
- •8. Аналіз суміші катіонів шостої аналітичної групи.
- •Аналіз суміші катіонів першої-шостої аналітичних груп з осадом
- •3. Відокремлення катіонів II та III аналітичних груп.
- •7. Відокремлення Нg, HgNh2Сl.
- •8. Відокремлення РbSо4.
- •9. Виявлення катіонів III аналітичної групи.
- •10. Аналіз центрифугату (і) (розділення та виявлення катіонів іv-vі аналітичних груп).
- •Реакції та аналіз аніонів. Аналіз сухої речовини.
- •Лабораторна робота 10. Реакції та аналіз аніонів першої аналітичної групи sо,sо,со,f–, s2o32–, b4o72–, ро, с2о,SiO.
- •Реакції аніонів першої аналітичної групи
- •1. Дія розчину барій хлориду
- •2. Дія розчину аргентум нітрату
- •Реакції сульфат-іонів
- •1. Дія розчинних солей плюмбуму (II)
- •Реакції сульфіт-іонів
- •1. Дія окисників
- •2. Дія мінеральних кислот
- •Реакції оксалат-іонів
- •1. Дія розчину кальцій хлориду
- •2. Дія розчину калій перманганату (калій тетраоксоманганату (VII))
- •Реакції фторид-іонів
- •1. Дія розчину кальцій хлориду
- •2. Дія розчину ферум (ііі) хлориду
- •Реакції карбонат-іонів
- •1. Дія мінеральних кислот
- •Реакції фосфат-іонів
- •1. Дія магнезіальної суміші
- •2. Дія молібденової рідини
- •Реакції силікат-іонів
- •1. Дія мінеральних кислот
- •2. Дія солей амонію
- •Реакції тетраборат-іонів
- •1. Дія розчину аргентум нітрату
- •2. Дія розчину меркурій(іі) нітрату
- •3. Реакція на забарвлення полум’я
- •Реакції тіосульфат-іонів
- •6. Виявлення фосфат-іонів ро43–
- •7. Виявлення оксалат-іонів с2о42–
- •Реакції аніонів другої і третьої аналітичних груп Реакції хлорид-іонів
- •1. Дія групового реагенту АgNо3
- •2. Дія окисників
- •Реакції бромід-іонів
- •1. Дія групового реагенту АgNо3.
- •2. Дія хлорної води
- •Реакції іодид-іонів
- •1. Дія групового реагенту АgNо3
- •2. Дія плюмбум (II) нітрату Рb(no3)2
- •3. Дія хлорної води
- •Реакції сульфід-іонів
- •3. Дія розчину ферум (ііі) хлориду
- •Реакції нітрат-іонів
- •1. Дія дифеніламіну (с6н5)2nн
- •2. Дія ферум (II) сульфату FеSо4
- •Реакції нітрит-іонів
- •1. Дія калій іодиду кі
- •2. Дія кислот
- •3. Дія тіосечовини (nh2)2cs і сечовини ((nh2)2co)
- •4. Дія солей Кобальту (іі)
- •Реакції ацетат-іонів
- •1. Дія сульфатної кислоти
- •2. Дія ферум (III) хлориду FеСl3
- •3. Дія сульфатної кислоти і етилового спирту.
- •Контрольна задача. Аналіз суміші аніонів другої та третьої аналітичних груп
- •1. Виявлення та відокремлення аніонів II групи
- •2. Виявлення хлорид-іонів Сl–
- •3. Виявлення бромід-іонів Br– та іодид-іонів I–
- •4. Відокремлення сульфід-іонів s2–
- •5. Виявлення нітрит-іонів nо2–
- •6. Виявлення нітрат-іонів no3–
- •7. Виявлення ацетат-іонів сн3соо–
- •Лабораторна робота 12. Аналіз сухої речовини
- •Аналіз речовини, розчинної у воді
- •1. Виявлення катіонів I аналітичної групи
- •2. Виявлення катіонів II аналітичної групи
- •3. Виявлення катіонів III аналітичної групи
- •4. Виявлення катіонів IV аналітичної групи
- •5. Виявлення катіонів V аналітичної групи
- •6. Виявлення катіонів VI аналітичної групи
- •7. Виявлення аніонів і аналітичної групи
- •8. Виявлення аніонів II аналітичної групи
- •9. Виявлення аніонів iiі аналітичної групи
- •Аналіз речовини, нерозчинної у воді
- •1. Розчинення плюмбум (п) сульфату РbSо4
- •2. Розчинення аргентум хлориду та броміду АgСl, АgВг
- •3. Розчинення аргентум іодиду АgІ
- •4. Розчинення сульфатів ВаSо4, СаSо4, SrSо4
5. Дія металів, що більш активні за мідь (Fe, Zn, Al).
Дослід. У розчин солі Купруму занурюють шматочки цинку, алюмінію, або залізні ошурки. Через деякий час вони покриваються червоним осадом металічної міді:
Cu2+ + Fe Cu + Fe2+.
Реакція відбувається краще у слабкокислому розчині, для чого розчин підкислюють сульфатною кислотою (нітратна кислота заважає реакції).
6. Дія калій йодиду (ki).
Внаслідок взаємодії йонів Cu2+ та I– утворюється білий осад купрум (І) йодиду, що здається забарвленим у червоно-жовтий колір внаслідок адсорбції йоду:
2Cu2+ + 4I– 2CuI + I2.
Даній реакції заважають катіони Ag+, Pb2+, Bi3+ і катіони-окисники.
Дослід. Налийте в пробірку 2-3 краплі розчину купруму (II) сульфату, додайте 5–6 крапель розчину KІ. Зазначте аналітичний ефект.
6. Дія розчинних карбонатів (МехСо3).
Карбонати лужних металів при взаємодії з солями Купруму (ІІ) утворюють осади основної солі (CuOH)2CO3 зеленуватого кольору:
Cu2+ + 2CO32– + H2O (CuOH)2CO3 + CO2
Утворений осад розчиняється в кислотах, розчинах амоніаку і солей амонію. Подібний осад (суміш карбонату і основної солі) утворюють і катіони Ni2+.
Реакції катіонів Со2+
У сполуках Кобальт буває дво-, три- і чотиривалентний. Відомі кобальт (II) оксид – СоО, кобальт (III) оксид – Со2О3 і кобальт (IV) оксид – СоО2. Усі ці оксиди при розчиненні у хлоридній кислоті утворюють солі кобальту (II).
Гідратований йон кобальту (II) – [Со(Н2О)4]2+ має рожевий колір, а безводний – синій або зелений.
1. Дія амоній тіоціанату nн4sсn
Цей реактив утворює з йонами Со2+ забарвлену у синій колір комплексну сполуку:
Со2+ + 4SСN– [Со(SСN)4]2–
Цей комплексний аніон стійкий при наявності ацетону. В водних розчинах комплексний йон [Со(SСN)4]2– дисоціює на йони Со2+ і SСN–. Для зменшення його дисоціації вводять надлишок йонів SСN–. Він також легко екстрагується з водного розчину аміловим спиртом або сумішшю його з диетиловим ефіром.
Цій реакції не заважають йони Ni2+, але заважають йони Fе3+, які з аніоном SCN– утворюють комплексну сполуку Fе(SСN)3 червоного кольору. В таких випадках йони Fе3+ можна замаскувати, зв’язавши їх в більш стійкі безбарвні комплекси амоній флуоридом NH4F (або винною чи щавлевою кислотами).
Дослід. У пробірку налийте 2-3 краплі солі кобальту (II), додайте 6-8 крапель насиченого розчину NН4SСN і 5-6 крапель суміші амілового спирту та ацетону. Суміш збовтайте. Що спостерігається?
2. Дія а-нітрозо--нафтолу.
-нітрозо--нафтол (реактив Ільїнського) з солями Кобальту утворює осад пурпурно-червоного кольору.
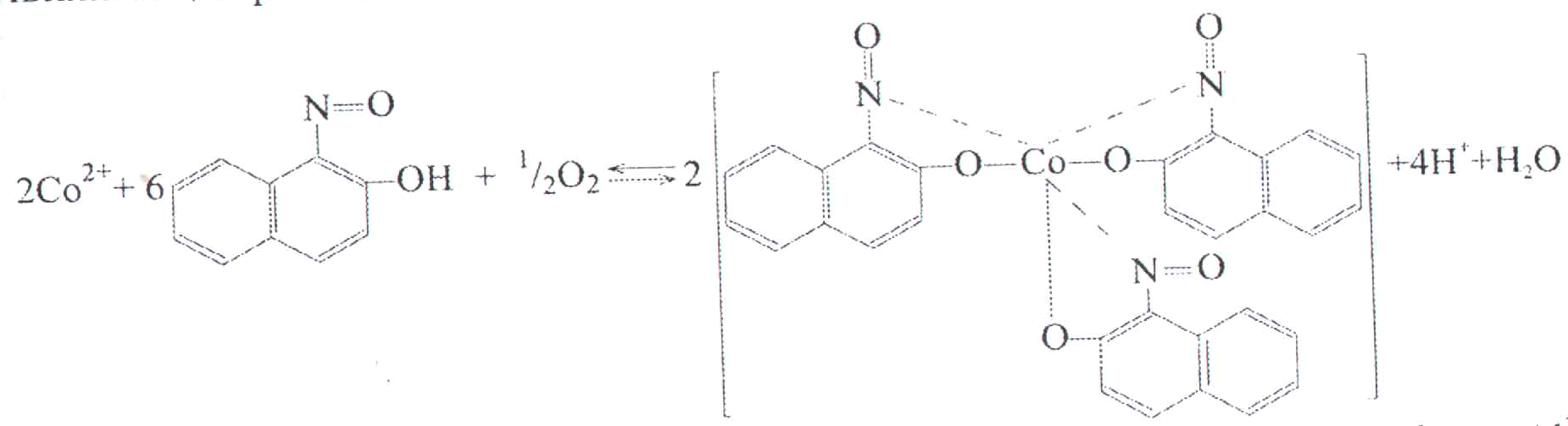
Цей осад не розчиняється в мінеральних кислотах, але добре розчиняється в органічних розчинниках (хлороформі, ефірі, етанолі та ін.). Умови проведення цієї реакції: свіжоприготовлений і концентрований розчин реактиву Ільїнського (частина цього реактиву витрачається на окиснення йонів Со2+ до Со3+), слабколужне середовище, наявність окисників (кисень повітря та ін.), відсутність Fе2+, Fе3+, Сu2+, Nі2+–іонів (осад з Сu2+ – кавово-бурий, Nі2+ – буро-жовтий, Fе3+ – буро-чорний, Fе2+ – зеленкуватий). Реакцію проводять краплинним методом.
Дослід. На смужку фільтрувального паперу нанесіть краплю розчину солі кобальту (II) (СoСl2, СоSО4). Витримайте смужку (1-2 хв) над відкритою склянкою з концентрованим розчином амоніаку. Додайте краплю -нітрозо--нафтолу і краплю 1М розчину Н2SO4. Спостерігайте появу пурпурно-червоного осаду.
