Фазовые равновесия и фазовые переходы
План
Фазы вещества. Равновесие фаз. Фазовая диаграмма (диаграмма состояния). Тройная точка. Уравнение Клайперона – Клаузиуса.
Фазой называется макроскопическая физически однородная часть вещества, отделённая от остальных частей системы поверхностью раздела. Фазовое равновесие – одновременное существование фаз в многофазной системе (без изменения одной фазы за счет другой).
Разные
фазы одного и того же вещества могут
находиться в равновесии, соприкасаясь
друг с другом. Такое равновесие наблюдается
лишь в ограниченном интервале температур,
причём каждому
значению температуры
![]() соответствует своё значение давления
соответствует своё значение давления
![]() ,
при котором возможно равновесие.
Совокупность состояний равновесия 2-х
фаз изображается на диаграмме
,
при котором возможно равновесие.
Совокупность состояний равновесия 2-х
фаз изображается на диаграмме![]() линией
линией![]() .Три фазы
одного и того же вещества (твёрдая,
жидкая и газообразная или жидкая и две
твёрдых или три твёрдых) могут находиться
в равновесии
только при единственных значениях
температуры и давления, которые на
диаграмме
.Три фазы
одного и того же вещества (твёрдая,
жидкая и газообразная или жидкая и две
твёрдых или три твёрдых) могут находиться
в равновесии
только при единственных значениях
температуры и давления, которые на
диаграмме
![]() соответствует
точка, называемая тройной.
соответствует
точка, называемая тройной.
В термодинамике доказывается, что равновесие более чем 3-х фаз одного и того же вещества невозможно (и это подтверждено экспериментально).
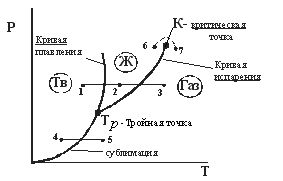
Диаграмма состояния. (рис. 12.1)
|
|
1-2-3
переход кристалл
4-5
кристалл
6-7 переход из жидкости в газ без расслоения на фазы. |
|
Рис. 12.1 |
|
Определение. Сублимация (возгонка) – непосредственный (без плавления) переход из кристаллического состояния в газообразное.
Из
диаграммы (рис. 12.1) следует, что жидкая
фаза может
находиться в
равновесии при давлениях не меньше,
чем давление в тройной точке
![]() .Например,
в случае углекислоты (
.Например,
в случае углекислоты (![]() )
)![]() =5,11
атм, поэтому при атмосферном давлении
(1 атм.) углекислота может существовать
только в твёрдом и газообразном
состояниях.Твёрдая
углекислота (называемая сухим льдом)
на воздухе сублимирует, а не тает
(переход 4-5). Для большинства же обычных
веществ
=5,11
атм, поэтому при атмосферном давлении
(1 атм.) углекислота может существовать
только в твёрдом и газообразном
состояниях.Твёрдая
углекислота (называемая сухим льдом)
на воздухе сублимирует, а не тает
(переход 4-5). Для большинства же обычных
веществ
![]() значительно меньше атмосферного давления
(например, для
значительно меньше атмосферного давления
(например, для![]()
![]() =4,58
мм. рт. ст.), поэтому переход из
кристаллического состояния в газообразное
осуществляется через жидкую фазу.
=4,58
мм. рт. ст.), поэтому переход из
кристаллического состояния в газообразное
осуществляется через жидкую фазу.
Кривая испарения заканчивается в
критической точке К.
Поэтому
возможен процесс в обход критической
точки К.
в этом случае переход из жидкого состояния
в газообразное совершается непрерывно
(процесс
![]() )без расслаивания
на две фазы.
При температурах выше критической
вещество не может быть сжижено никаким
сжатием.
)без расслаивания
на две фазы.
При температурах выше критической
вещество не может быть сжижено никаким
сжатием.
Фазовые переходы с поглощением или выделением скрытой теплоты перехода называются фазовыми переходами первого рода. Например, в процессах плавления или кристаллизации. Фазовые переходы, не связанные со скрытой теплотой перехода, называются фазовыми переходами второго рода. Например, переход парамагнетик – ферромагнетик.
Уравнение Клапейрона – Клаузиуса
(без вывода).
![]() теплота
фазового перехода,
теплота
фазового перехода,
![]() температура,
температура,![]() и
и![]() объёмы обеих фаз. (
объёмы обеих фаз. (![]() и
и![]() ,
,![]() относятся к одному и тому же количеству
вещества, например, к 1 молю или 1 кг, т.е.
является удеальными).
относятся к одному и тому же количеству
вещества, например, к 1 молю или 1 кг, т.е.
является удеальными).
![]() определяет наклон фазовой кривой
фазового равновесияР(Т).
Уравнение
Клапейрона – Клаузиуса даёт изменение
температуры фазового перехода при
изменении давления.
определяет наклон фазовой кривой
фазового равновесияР(Т).
Уравнение
Клапейрона – Клаузиуса даёт изменение
температуры фазового перехода при
изменении давления.
Пример.
Для воды (льда) теплота плавления
![]() .
Разница удельных объёмов льда и воды
при 0
.
Разница удельных объёмов льда и воды
при 0![]()
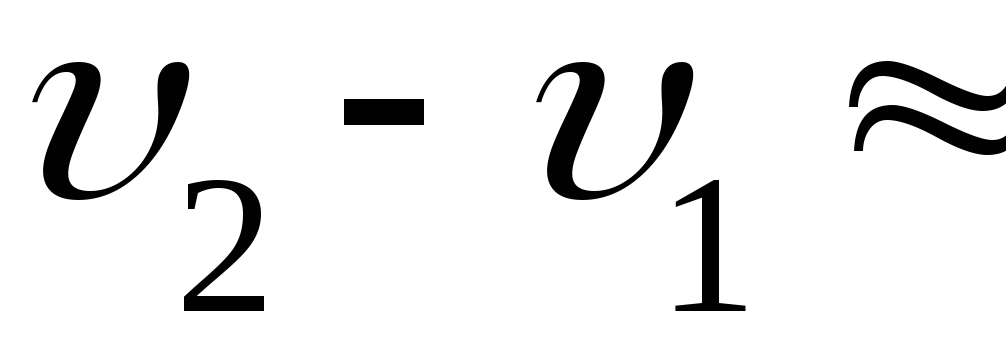
![]() (легко найти из соответствующих
плотностей).
(легко найти из соответствующих
плотностей).
![]()
![]() .
То есть, с увеличением давления на одну
атмосферу точка плавления льда понижается
примерно на 0,0075 град.
.
То есть, с увеличением давления на одну
атмосферу точка плавления льда понижается
примерно на 0,0075 град.
Опыт. Если на брусок льда, лежащий своими концами на неподвижных опорах, накинуть проволочную петлю, и к ней подвесить тяжёлый груз, то лёд под проволокой плавится. Вода выдавливается из-под проволоки и замерзает над ней. Проволока постепенно проходит через брусок, однако брусок остаётся неразрезанным.
Вопросы для самоконтроля.
1. Что называется фазой?
2. Нарисуйте фазовую диаграмму состояния в Р-Т координатах. Ука-
жите на ней тройную точку. Каков ее смысл?
3. Приведите примеры фазовых переходов и укажите их на диаграмме
состояния.
4. Запишите уравнение Клапейрона – Клаузиуса. Какие величины оно
связывает? Приведите пример использования этого уравнения.
Лекция №7 (13)