
Sivolob - Molekulyarna_biologiya_Pidruchnik
.pdf
Розділ 3. ДНК
Отже, хоча конструкція молекули ДНК є простішою за білкову, на сьогодні неможливо точно передбачити деталі структури ДНК, виходячи з її послідовності. Залежні від послідовності особливості структури подвійної спіралі та потенціал щодо конформаційних змін – основа механізму специфічного впізнання послідовностей ДНК білками.
Білково-нуклеїнові взаємодії
Структурна класифікація білків, які взаємодіють із ДНК
Так само, як більшість глобулярних білків можна вписати в обмежений набір стандартних укладок глобули (розділ 2), структурні елементи білків, які безпосередньо взаємодіють з ДНК, можна розділити на досить обмежену кількість стандартних типів – ДНК-зв'язувальних структурних мотивів.
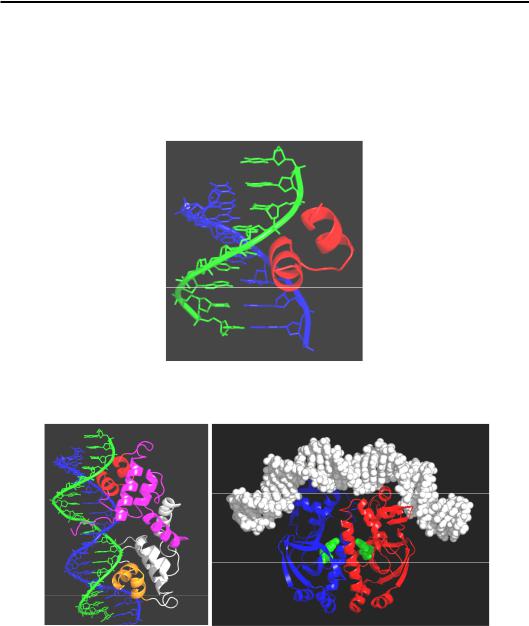
Мотив НТН (helix-turn-helix, спіраль–поворот–спіраль), приклад якого зображено на рис. 3.13, є найбільш розповсюдженим. Мотив складається із двох α-спіралей, часто майже перпендикулярних одна до одної, з'єднаних короткою перемичкою. Одна із цих спіралей (яка впізнає) виконує роль “головки, що читає”, взаємодіючи з екзоциклічними групами азотистих основ у великому жолобку подвійної спіралі. Орієнтація цієї спіралі відносно ДНК може варіювати для різних білків від приблизно перпендикулярної відносно осі подвійної спіралі до паралельної цукрофосфатному остову. Друга α-спіраль часто утворює допоміжні контакти з цукрофосфатним остовом. Взаємодія α-спіралі з великим жолобком часто зустрічається і для інших ДНК-зв'язу- вальних мотивів. Причина полягає в майже точній просторовій відповідності між цими двома елементами – можна сказати, що α-спіраль є просторово комплементарною великому жолобку.
Двоспіральний НТН-мотив утримується в структурі того чи іншого структурного домену – у випадку репресора фага λ, у структурі α-спі- рального пучка (рис. 3.14, а). Часто білки, що містять НТН-мотив, взаємодіють з ДНК у вигляді гомодимеру (дві однакові субодиниці) – це особливо характерно для прокаріотичних білків. Тоді дві однакові “читаючі головки” впізнають дві однакові послідовності, що симетрично розташовані в сайті взаємодії.
Інший приклад такого ж типу – катаболітний активаторний білок
(CAP – Catabolite Activator Protein) Escherichia coli (рис. 3.14, б). При вза-
ємодії гомодимеру САР зі специфічним сайтом відбувається досить знач-
81
Сиволоб А.В. Молекулярна біологія
ний вигин ДНК у бік білка (подвійна спіраль “огортає” білок). Спорідненість білка до цього сайта залежить від ліганду – сАМР (циклічного АМР – 5'-фосфат у складі нуклеотиду утворює внутрішній ковалентний зв'язок з 3'-ОН групою рибози). Зв'язування сАМР індукує структурні зміни в молекулі білка (див. розділ 2), у результаті змінюється робоча поверхня і білок набуває здатності впізнавати специфічну послідовність.
Рис. 3.13. НТН-мотив репресора бактеріофага λ у комплексі з ДНК (1LMB)
а |
б |
Рис. 3.14. Комплекси з ДНК гомодимерів репресора бактеріофага λ (а, 1LMB) і білка САР E. coli (б, 1CGP – зеленим кольором позначено молекули сАМР)
82

Розділ 3. ДНК
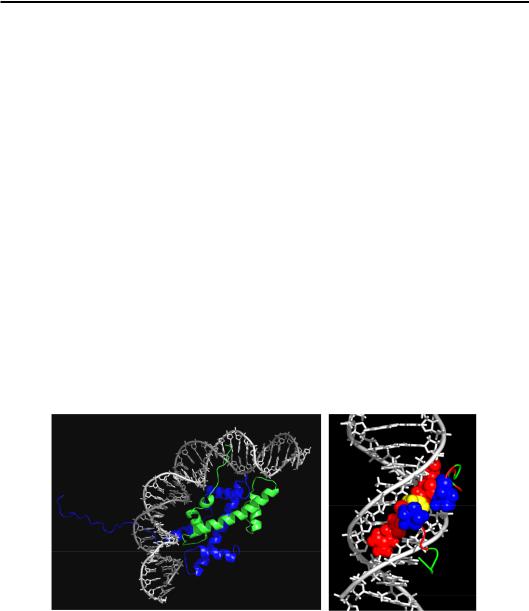
Розповсюджений клас білкових мотивів, що взаємодіють із ДНК, – Zn-координуючі мотиви. Це дуже невеличкі структурні елементи, які складаються з обмеженої, недостатньої для формування жорсткої глобули, кількості сегментів вторинної структури. Іон цинку надає жорсткості такому мотиву, утворюючи координаційні зв'язки з чотирма амінокислотними залишками, частіше Cys або His. Координаційний зв'язок формується неподіленою парою електронів атомів O, N або S, яка узагальнюється з атомом металу шляхом часткового “перетікання” на його низьку незаповнену орбіталь. Чотири такі зв'язки створюють жорсткий каркас, який утримує білкову поверхню, що має взаємодіяти з ДНК.
Один зі структурних мотивів такого типу, що часто зустрічається, – цинковий палець (Zn finger, рис. 3.15, а). Він має дуже просту будову: одна α-спіраль і маленький β-шар із двох β-ділянок; одна з них і α-спі- раль містять залишки, що утворюють координаційні зв'язки з Zn. Як правило, кілька таких пальців (три на рис. 3.15, а), з'єднаних перемичкою, спірально обгортають великий жолобок.
Інший приклад – ДНК зв'язувальний домен гормонового рецептора (рис. 3.15, б). Гормонові рецептори – це еукаріотичні фактори транскрипції, здебільшого гомодимери, які набувають споріденості з певними елементами послідовності ДНК після зв'язування з білком стероїдного гормону (розділ 6). ДНК-зв'язувальний домен має дві пари структурних елементів, а саме α-спіраль – суміжна нерегулярна петля, кожна пара координує іон Zn. Одна пара елементів бере участь у димеризації, інша – у взаємодії з ДНК. Зустрічаються також інші Zn-координуючі мотиви, але всі вони, як і розглянуті, реалізують взаємодію α-спіралі з великим жолобком.
Ще один мотив, який взаємодіє з великим жолобком ДНК за рахунок α-спіралей – лейциновий зіпер (Leu zipper, рис. 3.16). Він являє собою дві довгі α-спіралі, кожну з яких можна розділити на дві частини. Одна частина обох спіралей здійснює димеризацію – за рахунок гідрофобних взаємодій між неполярними амінокислотними залишками (часто Leu, звідки назва мотиву) утворюється трохи закручена подвійна спіраль (coiled coil). Друга частина кожної α-спіралі взаємодіє з великим жолобком ДНК.
Варіацією лейцинового зіпера є мотив спіраль – петля – спіраль (helix – loop – helix) – різниця лише в тому, що кожна довга α-спіраль розділена на дві коротші, з'єднані петлею: одна пара спіралей взаємодіє між собою, інша – з ДНК.
83

Сиволоб А.В. Молекулярна біологія
а |
б |
Рис. 3.15. Три цинкових пальця у складі ДНК-зв'язувального білка (а, 1ZAA)
і ДНК-зв'язувальний домен (димер) глюкокортикоїдного рецептора (б, 1GLU). Зелені сфери – іони Zn
Рис. 3.16. Лейциновий зіпер (1NWQ)
84
Розділ 3. ДНК
Усе це не означає, що тільки α-спіраль використовується для взаємодії білків з великим жолобком ДНК. У великий жолобок добре вкладається також β-шар із двох β-ділянок – саме такий шар є взаємодіючим елементом для білків типу метіонінового репресора. Численний клас білків становить родину імуноглобуліноподібних траскрипційних факторів (глобула має укладку імуноглобулінового типу, див. рис. 2.12, б), які реалізують взаємодії перемичок між ділянками β-структури з великим жолобком. Отже, хоча α-спіраль використовується частіше, реалізуються і всі інші можливості.
Усе описане не означає також, що білки взаємодіють з ДНК тільки через великий жолобок (хоча через великий – частіше). На рис. 3.17 зображено приклади взаємодії перемичок між α-спіралями (а) чи витягнутого поліпептидного ланцюга (б) з маленьким жолобком. У першому випадку – димер гістонів у складі нуклеосоми (див. розділ 4) – маємо ще один структурний мотив, який зустрічається і в інших ДНК-зв'язувальних білках, а саме гістонову укладку: одна довга α-спіраль фланкована двома короткими. Димер двох таких укладок взаємодіє з ~2,5 витками подвійної спіралі. У випадку гістонів ця взаємодія не є специфічною: утворюються електростатичні контакти позитивно заряджених амінокислотних залишків з фосфатами ДНК, але з боку маленького жолобка.
а |
б |
Рис. 3.17. Димер гістонів Н3-Н4 (а, 1AOI) і АТ-гак у складі білка HMGA (б, 2EZD)
Другий приклад (рис 3.17, б) стосується білків HMGA – білків групи високої рухливості (High Mobility Group) типу А (HMG – істо-
85
Сиволоб А.В. Молекулярна біологія
рична назва для білків різних структурних класів, мається на увазі рухливість при електрофорезі). Білки HMGA взагалі не мають глобулярної структури – є невпорядкованими. Вони містять 3 пентапептидні елементи (Pro-Arg-Gly-Arg-Pro), що називаються АТ-гаками (АТ-hook). Такий гак добре укладається у звужений маленький жолобок невеликої ділянки подвійної спіралі, збагаченої АТ-парами (тобто АТ-гак має специфічність до невеликих АТ-збагачених сайтів, завдяки чому він і отримав свою назву).
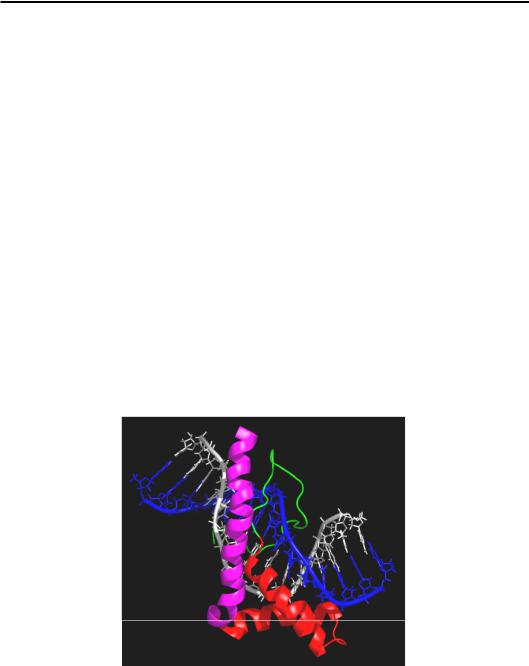
Наступні приклади стосуються дуже важливих випадків взаємодії елементів регулярної вторинної структури білків з маленьким жолобком. Оскільки α-спіраль і дволанцюговий β-шар добре укладаються у великий жолобок, це автоматично означає, що в маленькому жолобку їм не вистачає місця. Відповідно, така взаємодія буде можливою тільки за умови суттєвої деформації подвійної спіралі ДНК (розширення жолобка) – ефект, що має важливі функціональні наслідки. На рис. 3.18 зображено досить розповсюджений мотив – HMG-бокс, який, зокрема, входить до складу білків HMGВ (ще один клас білків HMG). Мотив складається з трьох α-спіралей, дві з них (позначені червоним) вбудовуються (інтеркалюють) у маленький жолобок. Це супроводжується розкрученням подвійної спіралі й вигином на ~80° у протилежний щодо білка бік. Серед HMG-боксів є як специфічні до певних послідовностей пар основ, так і неспецифічні.
Рис. 3.18. HMG-бокс у складі білка HMGВ (1J5N)
86
Розділ 3. ДНК
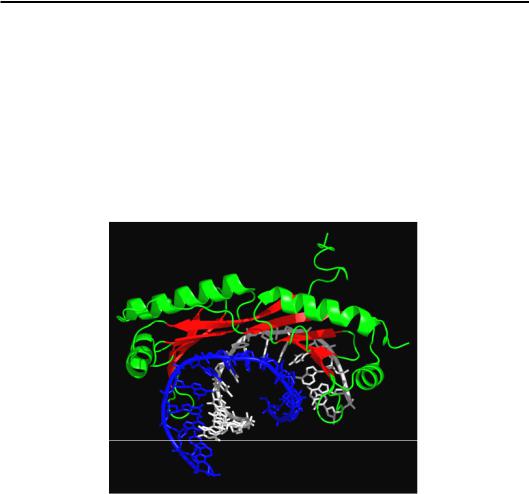
У складі білка ТВР (TATA-box Binding Protein) – важливого елемента ініціації транскрипції в еукаріотів – досить широкий β-шар взаємодіє з маленьким жолобком подвійної спіралі в зоні ТАТА-боксу – регуляторного елемента послідовності ДНК (розділ 6). Наслідком цієї взаємодії також є значна деформація подвійної спіралі з її розкрученням і значним вигином у протилежний від білка бік (рис. 3.19). Вигин, як і у випадку HMG-боксу, підсилюється інтеркаляцією двох гідрофобних амінокислотних залишків між парами основ. У місці інтеркаляції порушуються стекінг-взаємодії та утворюється кінк (kink) – різкий злам подвійної спіралі.
Рис. 3.19. ДНК-зв'язувальний домен ТВР у комплексі з ТАТА-боксом (1QNE)
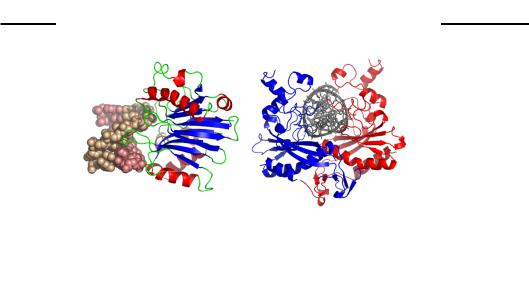
На відміну від розглянутих факторів транскрипції та структурних білків, ферменти, які працюють на ДНК, досить важко описати в термінах простих структурних мотивів. Ферменти використовують складні комбінації різноманітних елементів білкової структури для впізнання ДНК і зв'язування з нею. Два приклади – мономерна ДНКаза І (неспецифічна ендонуклеаза, яка здійснює одноланцюговий розріз в ділянці маленького жолобка) і гомодимерна рестриктаза EcoRV – зображені на рис. 3.20.
87
Сиволоб А.В. Молекулярна біологія
а
б
Рис. 3.20. Комплекси з ДНК ДНКази І (а, 1DNK) і рестриктази EcoRV (б, 1AZ0)
Принципи білково-нуклеїнового впізнання
Усі випадки взаємодії численних білків із ДНК можна поділити на дві категорії: неспецифічне зв'язування білка з ДНК будь-якої послідовності (характерна константа зв'язування K ~ 105–106 л/моль, визначення константи зв'язування див. у розділі 1) і специфічне впізнання білком певної послідовності пар основ (із константою ~109–1010 л/моль). Білки, що здійснюють таке впізнання, як правило, взаємодіють і з будь-якою іншою ДНК неспецифічно. Розглянемо на простому прикладі, що практично означають наведені цифри.
Нехай у бактеріальній клітині радіусом 1 мкм міститься 10 молекул певного білка та 4 млн 600 тис. пар основ ДНК, де присутня одна специфічна ділянка (оператор). Виходячи з об'єму клітини, можна легко розрахувати загальні молярні концентрації білка та оператора (скориставшись числом Авогадро). Концентрація комплексу з оператором визначається рівнянням (1.6), де вільні концентрації білка та оператора дорівнюють їхнім загальним концентраціям мінус концентрація комплексу. Звідки, якщо відома K, можна розрахувати концентрацію комплексу.
Якщо білок зв'язується неспецифічно (K = 105 л/моль), відношення концентрації комплексу до загальної концентрації оператора дорівнює 4·10–4 – оператор практично є вільним від білка. Та якщо замість концентрації оператора використати загальну концентрацію потенційних сайтів зв'язування на ДНК (білок зв'язується будьде), яка є в 4 млн 600 тис. разів вищою (кожна пара основ потенційно може бути початком сайта зв'язування), то відношення кон-
88

Розділ 3. ДНК
центрації комплексу до загальної концентрації білка дорівнюватиме 0,995 – практично білок увесь час зв'язаний із ДНК.
При специфічному зв'язуванні (K = 1010 л/моль), відношення концентрації комплексу до загальної концентрації оператора дорівнює 0,97 – десяти молекул білка виявляється достатнім, щоб більшу частину часу оператор був зв'язаним. При цьому з оператором у нашому прикладі в даний момент часу може бути зв'язана лише одна молекула білка, решта перебуває не у вільному стані, а на ДНК, взаємодіючи з нею неспецифічно.
Чим визначається висока специфічність зв'язування? Головне пра-
вило білково-нуклеїнового впізнання – відсутність жорстких правил.
Розглянуті різні структурні мотиви білків є різними еволюційними рішеннями для специфічної взаємодії з тією чи іншою послідовністю: існує багато шляхів для того, щоб сформувати білкову поверхню для впізнання послідовності пар основ. Не існує і будь-якого коду впізнання – чіткої відповідності між амінокислотними залишками та парами основ. Але є певні загальні закономірності, частина яких уже має бути зрозумілою з розгляду ДНК-зв'язувальних структурних мотивів. Зокрема, білково-нуклеїновий інтерфейс частіше представлений парою α-спіраль – великий жолобок завдяки хорошій просторовій відповідності між цими двома елементами. Проте використовуються також і β-структура, і перемички між елементами вторинної структури для впізнання пар основ у великому жолобку. Маленький жолобок також використовується для впізнання послідовностей пар основ, причому у випадку взаємодії елементів вторинної структури білка (α-спіраль чи β-структура) із маленьким жолобком така взаємодія супроводжується розкриттям маленького жолобка. Таке розкриття стає можливим унаслідок значної деформації подвійної спіралі (розкручування, вигин, кінк у результаті порушення стекінг-взаємодій).
На поверхні ДНК розташовані фосфатні залишки та донорні / акцепторні групи азотистих основ у жолобках. Саме ці групи й залучаються до контактів з амінокислотними боковими залишками та пептидними групами на поверхні білка. Існує декілька типів контактів
(взаємодій) між ДНК і білками:
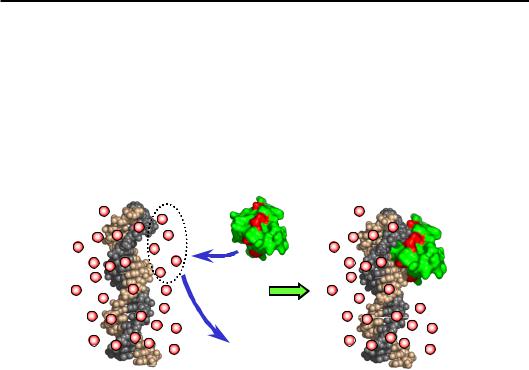
Електростатичні взаємодії між позитивно зарядженими амінокислотними залишками та негативно зарядженими фосфатами присутні майже завжди в білково-нуклеїнових комплексах. Зрозуміло, що електростатичні взаємодії відповідають за неспецифічне зв'язування. Як правило, вони додатково стабілізують також і специфічні комплекси. Електростатичне зв'язування білка з нуклеїновою кислотою має цілком ентропійну природу (див. також розділ 1). Висока концентра-
89
Сиволоб А.В. Молекулярна біологія
ція негативних зарядів (фосфатів) на поверхні ДНК зумовлює формування навкруг ДНК “іонної атмосфери” з досить високою локальною щільністю катіонів (рис. 3.21). Зв'язування позитивно зарядженого білка призводить до визволення частки катіонів у зовнішній розчин, тобто до зростання невпорядкованості (ентропії) у системі. Енергетичний виграш від зв'язування білка (його спорідненість до ДНК) є тим більшим, чим меншою є концентрація солі в розчині, тобто різниця між концентрацією катіонів поблизу від ДНК і на віддаленні від неї.
|
+ |
+ |
+ |
|
+ |
+ |
|
|
|||
|
|
|
|
|
|
|
|
||||
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
||
+ |
+ + |
|
+ |
+ |
|
+ |
|
|
|||
|
|
|
|
+ |
|
|
|||||
|
+ |
|
|
+ |
|
+ |
|
|
|
|
|
+ |
|
+ |
|
+ |
+ |
|
+ |
|
|
||
+ |
|
+ |
|
|
|||||||
|
|
|
+ |
|
|
|
+ |
||||
|
+ |
+ |
+ |
|
|
+ |
+ |
+ |
|
||
|
+ |
+ |
|
+ |
+ |
||||||
|
+ |
|
+ |
|
+ |
|
+ |
||||
|
+ |
+ |
+ |
|
+ |
+ |
+ |
||||
|
|
|
|
|
|
||||||
Рис. 3.21. Електростатичне зв'язування білка (червоним позначені позитивно заряджені амінокислотні залишки)
з ДНК за рахунок визволення неорганічних катіонів
Водневі зв'язки між донорно-акцепторними групами білка та фосфатами й екзоциклічними групами азотистих основ. Водневі зв'язки, оскільки вони потребують чіткої взаємної орієнтації донора й акцептора, відіграють роль головного фактора специфічного впізнання. Кожна послідовність пар основ утворює в жолобках подвійної спіралі власний патерн донорних і акцепторних груп (рис. 3.22, див. також рис. 3.7), який і може впізнаватися поверхнею білка. Слід зазначити, що цей патерн більш варіабельний у великому жолобку, де легше розрізнити пари основ і динуклеотидні контакти – це ще одна причина, чому саме великий жолобок частіше використовується для впізнання. Деякі амінокислотні залишки здатні утворювати два водневі зв'язки з азотистою основою, наприклад, Arg із гуаніном. Проте Arg контактує й з усіма іншими основами. Чи буде певний залишок залученим до утворення водневого зв'язку, і якого саме, залежить від його орієнтації на поверхні. Певні закономірності (своєрідний код, коли залишок пев-
90
