
Радіобіологія фул вершин (передмовалесс, вступлесс етс. едишн)
.pdf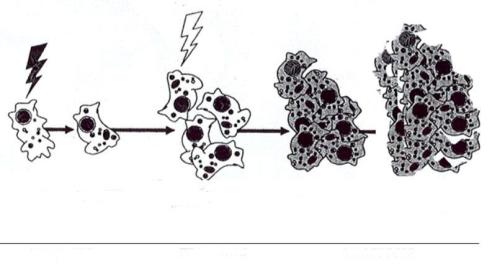
60
важливу роль, хоча для деяких пухлин, наприклад, гематологічних - це принципово.
Промотор
Ініціатор
Нормальна Ініційована |
|
|
|
|
клітина |
клітина |
Ріст |
Утворення |
Ріст пухлини |
|
|
|||
|
|
змінених |
пухлини |
|
|
|
клітин |
|
|
ІНІЦІАЦІЯ |
|
ПРОМОЦІЯ |
|
ПРОГРЕСІЯ |
Рис.3.19. Стадії онкогенезу
Подальше розгортання у клітині програми онкогенеза (стадія промоції) може здійснюватися за дії як зовнішніх чинників, так і внутрішніх факторів організму. Цьому передує формування популяції клітин із стабільними змінами в експресії генів, що передує їх злоякісному переродженню. Вважається, що дія негенотоксичного промотора полягає в стимуляції проліферації ініційованих клітин, що збільшує чисельність популяції клітин з первинною мутацією. При цьому зростає вірогідність вторинної мутації в будь-якій з клітин такої популяції, оскільки клітини, що діляться, більш чутливі до дії мутагенів. Генотоксичні канцерогени також можуть проявляти властивість пухлинних промоторів при дії навіть у низьких концентраціях. Слід зазначити, наявність в дії пухлинних промоторів концентраційного порога.
Стадія прогресії пухлинного росту пов’язана із посиленням швидкості проліферації клітин, зниження їх диференціювального потенціалу, прояв інвазивних властивостей та здібності до метастазування. Якщо у стадії ініціації онтогенезу відбуваються незначні пошкодження геному, то під час прогресії пухлинного процесу мають місце такі явища як хромосомні аберації (зміна числа
61
наборів хромосом або числа окремих хромосом, розриви хромосом, їх перебудови). Визначено, що радіаційно-індукована нестабільність генома може вносити суттєвий вклад в процес накопичення мутацій, які призводять до злоякісної трансформації.
Пухлинні клітини змінюються і фенотипово, набуваючи підвищеної здатності до проліферації і втрачаючи здатність до повного диференціювання і/або апоптичної загибелі. Завдяки цьому вони мають певні переваги перед клітинами нормальних тканин за однакових умов. На стадії прогресії відбуваються не лише глибокі порушення взаємодії між клітинами, але й між пухлиною та організмом.
Між опроміненням і розвитком пухлин проходить, як правило, певний час (латентний період), що обумовлено багатостадійністю канцерогенеза. У людини для певних злоякісних захворювань він може тривати понад 30 років. Термін прояву радіаційно-індукованого лейкозу, який має найменший латентний період, звичайно становить близько 10 років.
Лейкози відносяться також до злоякісних хвороб, частота виникнення яких більша, ніж інших онкозахворювань, що спричинені дією іонізуючої радіації. Це обумовлено як онкогенною дією іонізуючої радіації, так і безпосереднім її впливом на репродукцію клітин крові.
В дослідах на щурах показано, що підвищення у декілька разів частоти виникнення лейкозів, порівняно з контролем, може відбутися за гострого опромінення дозою 5–7 Гр і не менше 12–15 Гр при фракціонованому. Слід відмітити, що чим більша потужність дози, тим вища ймовірність розвитку лейкозів та інших онкозахворювань.
Особливістю онкогенної дії іонізуючого випромінювання є те, що загальне опромінення всього тіла викликає більшу частину появи лейкозів, ніж локальне (наприклад, лімфатичних вузлів). Крім того, загальне гостре опромінення у відносно великих дозах спричинює лейкози частіше, ніж фракціоноване і тим паче хронічне.
Оцінено, що за тривалого опромінення кісткового мозку людини частота виникнення лейкозів збільшується за доз 5–35 Гр. Так, кількість хворих на лейкоз людей, які пережили атомне бомбардування м.Хіросіми і м.Нагасакі серед осіб, опромінених дозою 10–14 Гр в 1960–1980р.р. становила за рік на 1 млн. населення 563– 1336 осіб, а дозою 0,3–2,0 Гр – 42–68 осіб. Слід відмітити, що спонтанний рівень лейкозів становить 11 осіб на 1млн. населення.
Лейкози є одними з поширених радіаційно-індукованих онкозахворювань, але виникають також інші, особливо в тканинах
62
і органах з високою проліферативною активністю їх клітин – яєчниках, яєчках, молочних залозах та ін.
Достатньо інтенсивне місцеве опромінення зі значною ймовірністю може призводити до виникнення онкозахворювань. При цьому, доволі тривалий час в ураженому органі відбуваються вялопротікаючі дегенеративно-некротичні та вогнищеві регенераторні процеси, що являється характерною ознакою передонкологічного стану.
Таблиця 3. 12. Ризик розвитку онкозахворювання в результаті пролонгованого опромінення, нормований на дозу 1 Зв (МКРЗ-90)*
Шлунок |
0,011 |
Шкіра |
0,002 |
Червоний кістковий мозок |
0,005 |
Легені |
0,0085 |
Молочні залози |
0,0002 |
Сечовий міхур |
0,003 |
Печінка |
0,0015 |
Стравохід |
0,003 |
Поверхня кісток |
0,0005 |
Товстий кишечник |
0,0085 |
Щитоподібна залоза |
0,0008 |
Яєчники |
0,001 |
Інші органи |
0,005 |
Усього |
0,05 |
*У випадку гострого разового опромінення в дозі вище 0,2 Зв значення ризику подвоюється
Вважається, що для людини граничні дози онкогенної дії іонізуючої радіації знаходяться в межах 0,5–5,0 Гр. Однак, як це вже відмічалося, домінуючою зараз концепцією є безпорогова дія іонізуючої радіації. Це означає, що для будь-якої малої дози опромінення не зникає ймовірність індукції онкозахворювання, однак вона знижується пропорційно до величини дози. Згідно з даним МКРЗ визначено номінальні значення ризику розвитку смертельних онкозахворювань протягом життя на одиницю дози прижиттєвого опромінення (табл. 3.12).
Контрольні питання та завдання
63
1.Характеристика „біологічної дії” іонізуючої радіації.
2.Які існують стадії реакції організму на іонізуюче опромінення? Дайте характеристику.
3.Які органи відносяться до критичних?
4.Які існують відмінності між радіаційним ураженням клітини та організму в цілому?
5.Які органи та тканини найбільш чутливі до дії іонізуючої радіації?
6.Яка природа радіаційного ураження критичних органів?
7.Яке явище називають мутацією? Які фактори здатні спричинити мутацію?
8.Мембранні структури, які пошкоджуються за дії іонізуючих випромінювань. Основні механізми порушення бар’єрних властивостей мембран.
9.Вільні радикали. Визначення та класифікація.
10.Походження і метаболізм супероксид-радикала.
11.Походження та дія на клітинні структури гідроксид-радикала.
12.Основні реакції ланцюгового окиснення ліпідів.
13.Вплив процесу пероксидного окиснення на клітинну структуру білків та ліпідів.
14.Основні методи визначення продуктів ПОЛ у клітині.
15.Що собою становить глутатіонзалежна система антиоксидантного захисту?
16.Які вітаміни володіють антиоксидантним захистом?
17.Пошкодження яких клітинних компонент за дії іонізуючої радіації є найбільш небезпечним для неї?
18.Форми загибелі опромінених клітин. Їх класифікація.
19.Поняття „малі дози” іонізуючої радіації.
20.Основні типи аберацій хромосом. Дайте характеристику.
21.Які основні стадії онкогенезу?
22.Що таке „радіаційно-індукована нестабільність геному”?
23.В чому різниця між однота дволанцюговими розривами молекули ДНК?
24.Що називають репарацією? Які процеси сприяють репарації?
25.Назвіть шляхи репарації ДНК у клітині.
26.В чому полягає процес відновлення клітин від радіаційного ушкодження?
27.Які радіаційні пошкодження називають сублетальними, потенційно сублетальними?
28.Що таке явище апоптозу?
29.Морфологічні ознаки некрозу та апоптозу.
64
30.Біохімічні ознаки апоптозу.
31.Роль цитохрому с в апоптозі.
32.Основні механізми апоптозу. Роль каспаз у апоптозі.
33.Дайте визначення стохастичним та детерміністичним ефектам.
34.Що таке „радіаційний гормезис”?
35.За яких умов опромінення спостерігається радіаційноіндукована адаптивна відповідь?
36.Що відомо у радіобіології про таке поняття як „ефект свідка”?
37.Які молекулярні механізми ініціації онкогенезу?
38.Назвіть основні теорії та гіпотези, що використовують для пояснення механізмів біологічної дії іонізуючої радіації.
65
РОЗДІЛ 4. РАДІОБІОЛОГІЯ ЛЮДИНИ
4.1. Радіаційне ушкодження людини
Радіаційні ефекти опромінення людини діляться на дві основні категорії (табл. 4.1):
1. Соматичні - виникають в органах та тканинах опроміненого організму. Відрізняють ранні соматичні ефекти, для яких характерна дозова залежність, а також пізні – до яких відносять зростання риска розвитку пухлин, скорочення тривалості життя та різних видів порушень функцій органів.
2. Генетичні (передаються в наступних поколіннях) - пов'язані з ушкодженням генетичного апарату або клітинних структур статевих органів (яєчників та сіменників). Вони виявляються в наступних поколіннях: це діти, онуки та більш віддалені нащадки опроміненої людини.
Проміжне положення між соматичними та генетичними пошкодженнями займають ембріотоксичні ефекти - вади розвитку – наслідки опромінення плоду. Він чутливий до опромінення особливо в період органогенезу (на 4 – 12 тижнях вагітності у людини). Особливо чутливий мозок плоду.
Таблиця 4.1. Радіаційні ефекти опромінення людини
Соматичні ефекти |
Генетичні ефекти |
Променева хвороба |
Генні мутації |
Локальні променеві ураження |
Хромосомні аберації |
Лейкози |
|
Пухлини різних органів |
|
Поняття критичного органа. Поглинена доза може розподілятися в біологічних об'єктах рівномірно і нерівномірно. Відомо, що кожний орган і кожна тканина мають різне значення в життєзабезпеченні всього організму. Критичний орган — це орган або тканина, частина тіла або все тіло, опромінення яких завдає найбільшої шкоди організму. Аналогічно критичні (життєво важливі) елементи можуть бути виділені й у кожній окремій клітині, а не тільки в цілому організмі (див. розділ 3).
Існують три способи виділення критичних органів:
1. За найбільшою радіочутливістю у певній системі організму.
2. За найбільшою поглиненою дозою випромінювання.
66
3. За вибірковим накопиченням підвищених концентрацій певного радіонукліда і, таким чином, отриманням найвищих ефективних еквівалентних доз випромінювання (для іншого радіонукліда критичним може бути зовсім інший орган).
Кожний із цих способів придатний для різних ситуацій. Перший спосіб зручний у разі загального рівномірного зовнішнього опромінення, другий — при нерівномірному опроміненні, третій — при поглинанні радіонуклідів у різних тканинах і органах. Відомо, що такий радіонуклід, як 131І, вибірково накопичується в щитоподібній залозі тварин і людини, і тому дозу оцінюють із розрахунку на цей орган. 90Sr зрештою зосереджується в поверхневих шарах кісток, і дозу потрібно перераховувати на цю тканину тощо.
За умов перебування людини в сфері зовнішнього опромінення, організм піддається впливу випромінювання і зміни в організмі обумовлені безпосереднім впливом радіації. У випадку припинення дії радіації в організмі розвиваються зміни – наслідки дії випромінювання. У табл.4.2 представлені дані стосовно віддалених наслідків впливу іонізуючих випромінювань.
Таблиця 4.2. Ризик та ймовірне число смертей від пухлин та
спадкових дефектів в результаті опромінення |
|
|
||
Критичний |
Захворювання |
Ризик, |
Число |
|
орган |
|
|
10-2 Зв-1 |
випадків, |
|
|
|
|
104люд.-Зв |
Все |
тіло, |
Лейкемія |
0,2 |
20 |
червоний |
|
|
|
|
кістковий |
|
|
|
|
мозок |
|
|
|
|
Щитоподібна |
Рак щитоподібної залози |
0,05 |
5 |
|
залоза |
|
|
|
|
Молочна |
|
Рак молочної залози |
0,25 |
25 |
залоза |
|
|
|
|
Скелет |
|
Пухлини кісткової тканини |
0,05 |
5 |
Легені |
|
Пухлини легень |
0,2 |
20 |
Всі |
інші |
Пухлини інших органів |
0,5 |
50 |
органи |
та |
|
|
|
тканини |
|
|
|
|
Всі органи та |
Всі злоякісні пухлини |
1,25 |
125 |
|
тканини |
|
|
|
|
Статеві залози |
Спадкові дефекти |
0,4 |
40 |
|
Всього |
|
|
1,65 |
165 |
67
За умов надходження радіоактивних речовин до організму, вони можуть накопичуватись різними тканинами й органами, стаючи джерелом внутрішнього випромінювання. Особливу небезпеку при цьому представляють довго живучі ізотопи, які протягом майже всього життя потерпілого можуть бути джерелами іонізуючого випромінювання.
По здатності концентрувати продукти поділу, що всмокталися, основні органи можна розташувати в наступний ряд: щитоподібна залоза > печінка > кістки > м'язи (табл. 4.3).
Так, у щитоподібній залозі накопичується до 30% продуктів, що всмокталися, переважно радіонуклідів йоду. На другому місці знаходиться печінка. Доза опромінення, що отримується цим органом, переважно обумовлена надходженням радіонуклідів Мо99,
Te132, I131, I132, Bа,140 Lа140.
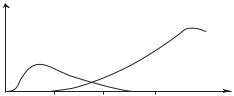
Дослідження приблизно 100 тис. чоловік, які пережили атомні бомбардування м. Хіросіми й м. Нагасакі, свідчать, що рак - найбільш серйозний наслідок опромінення людини. Першими серед ракових захворювань, що вражають населення, є лейкози (рис.4.1).
Розповсюдженими видами ракових захворювань є рак молочної залози та щитоподібної залози, які вважаються виліковними. Оцінки ООН показують, що у випадку раку щитоподібної залози летальний випадки спостерігаються в однієї людини з тисячі, опромінених при індивідуальній поглиненій дозі 1 Гр.
Таблиця 4.3. Органи людини, які найбільше накопичують
радіонукліди |
|
|
|
|
|
Елемент |
Найбільш |
Маса |
органа |
Частка |
від |
|
чутливий |
або |
тканини, |
повної дози * |
|
|
орган |
або кг |
|
|
|
|
тканина |
|
|
|
|
Гідроген |
H |
Все тіло |
70 |
1,0 |
Карбон |
C |
Все тіло |
70 |
1,0 |
Натрій |
Nа |
Все тіло |
70 |
1,0 |
Калій |
К |
М'язова |
30 |
0,92 |
|
|
тканина |
|
|
Стронцій |
Sr |
Кістка |
7 |
0,7 |
Йод |
I |
Щитоподібна |
0,2 |
0,2 |
|
|
залоза |
|
|
Цезій |
Сs |
М'язова |
30 |
0,45 |
|
|
тканина |
|
|
Барій |
Ва |
Кістка |
7 |
0,96 |
68
Радій |
Rа |
Кістка |
7 |
0,99 |
Торій |
Тh |
Кістка |
7 |
0,82 |
Уран |
U |
Нірки |
0,3 |
0,065 |
Плутоній |
Рu |
Кістка |
7 |
0,75 |
* Стосовно даного органа частка від повної дози, отриманої всім тілом людини.
Вірогідність |
|
|
|
Всі інші види |
|||
захворювання раком |
|
||
|
|
ракових |
|
|
|
захворювань |
|
|
|
|
Лейкози
|
|
|
|
Кількість років |
0 |
10 |
20 |
30 |
після опромінення |
Рис. 4.1. Відносна середньостатистична ймовірність захворювання раком після одержання разової дози в 1 рад (0,01 Гр) при рівномірному опроміненні всього тіла.
Таблиця 4.4. Вплив різних доз опромінення на людський організм
Доза, Гр |
Причина та наслідки впливу |
(0.7 – 2) 10-3 |
Доза від природних джерел у рік |
0,02 |
Гранично допустима доза професійного |
|
опромінення в рік |
0,1 |
Рівень подвоєння ймовірності генних мутацій |
0,25 |
Однократна доза виправданого ризику в |
|
надзвичайних обставинах |
1.0 |
Доза виникнення гострої променевої хвороби |
3 – 5 |
Без лікування 50% опромінених вмирає |
|
протягом 1−2 місяців внаслідок порушення |
|
діяльності клітин кісткового мозку |
69
10 – 50 |
Смерть настає через 1− 2 тижні внаслідок |
|
поразки головним чином шлунково-кишкового |
|
тракту |
100 |
Смерть настає через кілька годин або днів |
|
внаслідок пошкодження центральної нервової |
|
системи |
Стосовно генетичних наслідках опромінення - ці дані досить неоднозначні. Іонізуюче випромінювання може пошкоджувати життєздатні клітини, які передаватимуть генетичні зміни з покоління в покоління. Однак цей аналіз ускладнений, тому що приблизно 10% всіх немовлят мають ті або інші генетичні дефекти і серед них важко виділити випадки, обумовлені дією іонізуючої радіації.
Залежність ступеню радіаційних уражень від величини дози опромінення наведена в таблиці 4.4.
Експертні оцінки показують, що хронічне опромінення при дозі 1 Гр, отримане протягом 30 років, викликає близько 2000 випадків генетичних захворювань на кожен мільйон немовлят, які народжені від батьків, що піддавались опроміненню. В останні десятиліття процеси впливу іонізуючих випромінювань на людський організм детально досліджується.
4.2. Основні види радіаційних ушкоджень людини
Променеві ураження поділяють на гострі та хронічні, які в свою чергу бувають загальними і місцевими. Вони виникають за опромінення будь-якого виду опромінювань у великій дозі як зовнішнього так і внутрішнього. Гострі ураження розвиваються за короткочасного опромінення у високій дозі, а хронічні – при тривалій променевій дії у дозах, які перевищують гранично допустимі навантаження.
Загальні ураження виникають за опромінення великих ділянок тіла і називаються променевою хворобою, а місцеві (за локального впливу) – променевими ураженнями або променевими опіками,
оскільки за клінікою вони подібні до термічних.
В основі променевої хвороби лежать складні механізми прямого та непрямого впливу іонізуючого випромінювання на організм. На хід біохімічних процесів в уражених радіоактивним випромінюванням тканинах певний вплив справляють радіотоксини, зміна нейрогуморальної та гормональної регуляції тканин і клітин.
