
Радіобіологія фул вершин (передмовалесс, вступлесс етс. едишн)
.pdf10
можуть формувати потенційні пошкодження структур клітин. Причому, в інтервалі часу між потенційним пошкодженням та його реалізацією можливе протікання відновлювальних процесів, що підпорядковуються статистичним закономірностям.
Як відмічалось раніше (за використання метода культивування клітин), криві залежності виживання клітин від дози опромінення експоненційні на всій ділянці за умов коли пошкодження, що виникли, не можуть бути репаровані. Коли репарація можлива, за
умов сублетальних пошкоджень, |
початкова ділянка кривої має так |
|
зване, „плече” і лише за досягнення певної дози |
крива стає |
|
практично експоненційною (рис. |
3.7). Згідно однієї |
із існуючих |
гіпотез, якій на сьогодні надається перевага, здатность до репарації пояснюється існуванням у клітині деякого фактора Q, який може репарувати пошкодження до того, як воно проявиться. Ця репарація має назву Q – репарація і характеризується такими показниками, як
Dq - доза плеча чи квазипорогова доза, а також n - екстраполяційне число. Відновлення, що проявляється у зміні значення D0 , названо відновленням від потенційно летальних пошкоджень або Р- репарація. У клітинах, які не загинули від опромінення і здатні до відновлення,
спостерігається, так звана адаптивна відповідь. |
|
Одним із механізмів, що обумовлює |
здатність клітини |
відновлювати сублетальні пошкодження виступає процес репарації радіаційних порушень структури ДНК. У цьому задіяні різноманітні ферментні системи. В процеси післярадіаційного відновлення клітин залучені деякі гормони та фактори росту, які впливають на окремі хромосоми та їх фрагменти.
Згідно до сучасних уявлень, існують різноманітні шляхи репарації променевих пошкоджень на всіх рівнях організації живого: молекулярному, клітинному та рівні цілісного організма. В багатоклітинному організмі відновлення клітин від пошкоджень в різних тканинах та органах має певні особливості. Найбільша швидкість відновлення клітинного складу притамана активно проліферуючій тканині за рахунок репарації стовбурових клітин, що зберегли життєздатність. Згідно уявлення про принципи системної відповіді клітини на опромінення – формування радіаційних ефектів обумовлені як деструктивними процесами, так функціонуванням систем репарації, контроля та регуляції, що існують в клітині.
3.5. Реакція клітини на дію іонізуючих випромінювань
11
Клітини організму навіть в межах однієї тканини мають різну радіочутливість до дії іонізуючої радіації. Радіочутливість клітин пов’язана з особливостями їх метаболізму та прямо пропорційна швидкості метаболічних реакцій. Клітини з високим рівнем обмінних процесів більш чутливі до опромінення, ніж клітини, що знаходяться у стані спокою – в стаціонарній фазі.
Конкретні структурні та метаболічні зміни в кожній окремій клітині відрізняються, однак існують певні закономірності. Наслідком опромінення клітини є дозозалежне зниження ступеня упорядкування та ушкодження клітинних структур, які ультраструктурно виявляються у зменшенні площі поверхні клітини, набуханні клітин та мітохондрій, зникнення цитоплазматичних містків між клітинами. До числа найбільш ранніх реакцій на опромінення відноситься пригнічення синтезу ДНК, особливо у радіочутливих тканинах, що обумовлено пошкодженням ДНК-матриці чи інгібуванні процесів синтезу ферментів, які приймають участь у редуплікації ДНК.
У ядрах клітин активуються ендота екзонуклеази, що призводить до зростання ферментативного гідролізу ядерної ДНК. Зростання проникності внутрішньоклітинних мембран сприяє надходженню ферментів до ядра, а деконденсація хроматину підвищує доступність ядерної ДНК до дії ферментів. Біосинтез білка порушується мало. Однак поряд із зниженням чи, навіть припиненням синтезу ДНК можливі глибокі порушення структури та просторової організації нуклеопротеїнових комплексів.
Лізосоми - сферичні мембранні структури, які містять комплекс гідролітичних ферментів – кислих нуклеаз та протеаз. Пошкодження мембран лізосом у ранні терміни після опромінення призводить до виходу лізосомальних гідролази, що сприяє активації процесів протеолізу та зниженню активності інгібіторів протеаз. Це проявляється у зростанні рівня вільних амінокислот та інших аміносполук в тканинах та рідинах організму.
Біоенергетична активність клітини знижується у першу чергу за рахунок пригнічення процесів окиcного фосфорилювання у мітохондріях. Мітохондрії являють собою строго організовану систему окисно-відновних структур, що забезпечують перенесення протонів та електронів із первинних субстратів окиснення на кисень. Спряження реакцій дихального ланцюга із фосфорилюванням дозволяє акумулювати частину енергії окиснення у вигляді АТФ. Зниження мітохондріального окисного фосфорилювання – одне із важливих біохімічних порушень опромінених клітин, особливо радіочутливих тканин. Ефекти зниження окисного фосфорилювання
12
та роз’єднання процесів окиснення і фосфорилювання в мітохондріях обумовлені структурними пошкодженнями мітохондріальної мембрани та зростанням її проникності.
Плазматична та внутрішньоклітинні мембрани являють собою організовану клітинну систему: зовнішня мембрана ядерної оболонки безпосередньо переходить в мембрани ендоплазматичного ретикулуму, що пронизують цитозоль і утворюють сітку, які, у свою чергу, з’єднуються із мембранним апаратом Гольджи та плазматичною мембраною. Протікання важливих клітинних функцій відбувається за участі спеціалізованих мембранних структур, а їх пошкодження може впливати на життєздатність клітини.
Критичними для життєдіяльності опроміненої клітини є в першу чергу пошкодження таких структур, як ДНК та клітинні мембрани, функціонування яких пов’язано із системою окисно-відновної рівноваги у клітині.
СИСТЕМА ПРООКИСНО-АНТИОКСИДАНТНОЇ РІВНОВАГИ КЛІТИНИ.
Основу життєдіяльності клітин і всього організму складає система окисно-відновних процесів. Безпосередню участь у зародженні та протіканні реакцій цієї системи приймають активні форми оксигену
(АФО), активні форми нітрогену (АФН) та продукти пероксидного окиснення ліпідів (ПОЛ).
Вільні радикали – це частинки (атом чи молекула), що мають непарний електрон на зовнішній електронній оболонці та володіють високою реакційною здатністю. Радикали умовно поділяють на
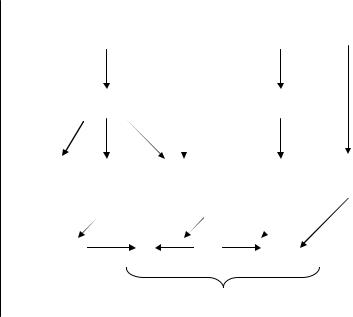
первинні та вторинні (рис.3.11):
– Первинні радикали - утворюються за участі певних ферментних систем. Перш за все, до них відносяться радикали (семихінони), що утворюються в реакціях таких переносників електронів, як коензим
Q та флавопротеїни, а також супероксиду аніон (·OO-) та нітрогену монооксид (NO·). В результаті протікання хімічних реакцій за участі радикалів утворюються активні сполуки оксигену (гідроген пероксиду), активні сполуки нітрогену – пероксинітрит (результат взаємодії нітроген оксиду із супероксидом), активні сполуки хлору – гіпохлорит.
– Вторинні радикали - утворені в реакціях із сполуками клітини (ліпідами, білками, ДНК). До них відносяться і радикали ліпідів, які утворюються в реакціях ланцюгового окиснення ліпідів. Важливу роль у протіканні цих реакцій відіграють іони перемінної валентності, у першу чергу іони двовалентного ферума. Вторинні радикали володіють руйнівною дією на клітинні структури.
13
|
|
|
Активні форми |
|
|
|
|
Кисню |
Ліпідів |
Азоту |
Хлору |
Первинні |
|
|
|
|
|
радикали |
|
∙ОО- |
|
∙NO |
|
|
|
|
|
||
|
Супероксид |
|
Нітроксид |
|
|
Активні |
|
|
|
|
ClO- |
молекули |
1О2 |
НООН |
LOOH |
ONOOH |
|
|
Синглетний |
Пероксид |
Ліпогідро- |
Пероксинітрит |
Гіпохлорит |
|
кисень |
водню |
пероксиди |
|
|
Вторинні |
HO∙ |
|
|
|
|
радикали |
L· |
LO· |
LOO· |
|
|
|
Радикал |
Алкіл |
Алкоксил |
Діоксил |
|
|
гідроксилу |
|
|
|
|
Радикали ліпідів
Рис. 3.11. Активні форми оксигену, нітрогену та хлору
Виявлення вільних радикалів у біологічних системах досить складна задача у зв’язку з їх нестабільністю, швидким спонтанним розпадом та включенням до клітинного метаболізму продуктів ліпопероксидації. На сьогодні існують високочутливі біофізичні та біохімічні методи для виявлення радикалів. Вони поділяються на прямі методи - електронний парамагнітний резонанс (ЕПР), ядерний магнітний резонанс (ЯМР), хемілюмінесценції (ХЛ) тощо та непрямі методи.
Метод ЕПР використовується для дослідження речовин, які містять неспарені електрони: вільні радикали, іон-радикали, молекули у триплетних станах, іони та комплекси перехідних металів. Характерний для досліджуваного радикала сигнал ЕПР виникає у результаті взаємодії молекули речовини із магнітним полем. У біологічних системах швидкість утворення радикалів оксигену чи ліпідних радикалів у мембрані набагато нижча за швидкість їх зникнення, тому концентрація радикалів у певний момент часу така мала, що їх важко визначити методом ЕПР. Ця проблема вирішується наступним чином – активні радикали переводять в неактивні, за допомогою особливих речовин (спінові пастки). Спінова пастка – це
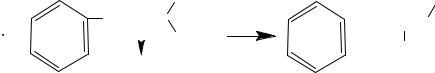
14
реагент, який здатен приєднувати радикал із утворенням відносно стабільного спінового аддукта, що накопичується у достатній концентрації для реєстрації за допомогою ЕПР. Наприклад, для „захоплення” гідроксид-радикалів HO. використовують фенілбутилнітрон (ФБН) (рис. 3.12)
|
|
|
|
|
|
CH3 |
|
|
C |
|
N |
|
CH3 |
||
|
|
|
|||||
|
|
|
|||||
HO + |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||
H |
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
O |
|
|
|
радикал |
спінова мітка (ФБН) |
||||||
гідроксилу |
|
|
|
|
|
|
|
CH3
 N
N 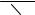 CH3
CH3
OH O CH3
CH3
спіновий
аддукт
Рис. 3.12. Використання фенілбутилнітрона у якості спінової пастки
Метод хемілюмінесценції („надслабкого світіння”) –
застосовується для виявлення вільнорадикальний реакцій у тканинах запропоновано Ю.А. Владимировим та Ф.Ф.Літвіновим у 1959 р. Він заснований на здатності радикалів при взаємодії виділяти енергію, яка може випускатись у вигляді фотонів (квантів світла). Інтенсивність такого світіння (ХЛ) пропорційна швидкості реакції, у якій приймають участь радикали, і, відповідно показує зміни їх концентрації у процесі реакції. Пізніше (Б.Н.Тарусов із співробітниками у 1972 р.) показано, що за нормальних умов у інтактних біологічних системах ХЛ випромінюється стабільно, неперервно. Іонізуюче випромінювання ініціює спалах ХЛ, що обумовлено переходом стаціонарного процеса у процес самоприскорюючийся, який супроводжується утворенням стійких вільних радикалів.
Спалах ХЛ може бути підсилений впливом електричного струма (метод електрохемілюмінесценції - ЕХЛ). Цей метод дозволяє оцінити складні багатопланові процеси, які взаємопов”язані із реакцією вільнорадикального окиснення.
До непрямих методів дослідження властивостей вільних радикалів, які виникають у ліпідах, білках та нуклеїнових кислотах відноситься визначення концентрації кінцевих продуктів реакції, а також використання інгібіторів (метод інгібіторів). Як приклад, - це дослідження активності ферменту супероксиддисмутази (СОД). Цей фермент каталізує реакцію взаємодії (дисмутації) двох супероксидних радикалів із утворенням гідроген пероксиду.
[О2-∙] + [О2-∙] + 2Н+  Н2О2 + О2
Н2О2 + О2

15
Якщо додавання СОД гальмує цей процес, то для його протікання необхідний супероксид-радикал.
Активність іншого ферменту, каталази, у присутності якого гідроген пероксиду розкладається із утворенням оксигену та води, визначають за швидкістю перетворення пероксиду, який залишився у ході реакції розкладу, у присутності солей молібдену.
Активні форми оксигену. До активних форм оксигену (АФО) належать радикали (супероксид, гідропероксид, гідроксид) та нейтральні молекули (гідроген пероксиду, синглетний оксиген). Головні місця їх утворення - мітохондріальна, ядерна, плазматична, мікросомальна мембрани у тварин та хлоропласти і хроматофори у бактерій.
У клітинах існують ферментні та неферментні шляхи утворення АФО. У протіканні ферментних (метаболічних) шляхів утворення АФО приймають участь: дихальний ланцюг мітохондрій та система мікросомального окиснення, системи оксидаз (ксантин-, флавін-, НАДФН-оксидази) та цитохромів, глутатіонпероксидаза та супероксиддисмутаза (СОД). Неферментне утворення основних АФО у
клітині в реакціях одноелектронного відновлення кисню |
до води |
||||
відбувається наступним чином (рис. 3.13): |
|
|
|||
|
О · + 2Н+ + Fе3+ |
1О2 |
|
|
|
|
2 |
|
|
|
|
|
↑ |
|
|
|
|
О 2 · + e- |
О 2 · + e- |
+ 2Н+ |
Н2О2 +e- |
HO· + e- + Н+ |
Н2О2 |
|
↑↓ |
|
|
|
|
|
( Н+ ) |
НО2· |
|
|
|
Рис. 3.13. Схема послідовності неферментативного утворення АФО у клітині
Синглетний оксиген (1О2) приймає участь в ініціюванні вільнорадикального окиснення. У клітинах він може утворюватись в реакціях, що протікають за участі пероксидаз, ліпоксигеназ, а також в процесі мікросомального НАДФH-залежного ПОЛ. За умов нехватки СОД у присутності металів перемінної валентності можлива спонтанна дисмутація супероксидів із утворенням синглетного кисню (рис.3.13). Синглетний кисень не являєтся вільним радикалом.

16
Однак, в реакціях із біомолекулами, він призводить до появлення вільних радикалів. Установлено, що синглетний кисень може ініціювати пероксидне окиснення холестеролу та ненасичених жирних кислот.
Гідроген пероксид (Н2О2) утворюється при функціонуванні флавін-, мідьта гемовмісних оксидаз, а саме: мітохондріальної моноамінооксидази, НАД–убіхінонредуктази, убіхінон–цитохром с– редуктази та СОД. Інші шляхи його утворення:
а) у реакції супероксида із електроном та двома протонами:
О |
|
· +e- + 2Н+ |
Н2О2 |
|
2 |
|
|
б) у реакції дисмутації супероксидів у присутності СОД:
О |
|
· + О |
|
· + 2Н+ |
Н2О2 + О2 |
|
2 |
|
2 |
|
|
Гідроген пероксид не являється вільним радикалом, однак володіє здатністю ініціювати вільнорадикальне окиснення, тому відноситься
до цитотоксичних агентів. |
|
|
|
Супероксиду аніон (О2-∙) утворюється |
|
шляхом приєднання до |
|
молекули кисня одного електрона: |
|
|
|
О2 +e- |
О |
|
· |
|
|
2 |
|
Донорами електронів у клітині слугують |
іони металів перемінної |
||
валентності, семіхінони та інші речовини, що приймають участь у процесі дихання. За іонізуючого опромінення електрони генеруються у результаті іонізації води та біоорганічних молекул.
Супероксиду аніон-радикал (О2-∙) та H2O2 відрізняються слабкою реакційною здатністю, але відносяться до головних ініціаторів вільнорадикального окиснення в клітині, оскільки взаємодія цих речовин призводить до виникнення самого активного внутрішньоклітинного ініціатора вільнорадикального окиснення - радикала гідроксиду (HO·). Крім того, молекула H2O2 відносно довгоживуча, дифундує на значні відстані і виступає „дифундуючою” формою HO·.
Радикал гідроксиду (HO·) у клітині утворюється із H2O2 внаслідок
протікання різних реакцій: |
|
|
|
Н2О2 +e- |
|
HO· |
|
Н2О2 |
+ Fе2+ |
HO· + HO+ + Fе3+ |
|
Н2О2 |
+ О |
· |
HO· + HO- + О2 |
|
2 |
|
|
Цей радикал хімічно активний та викликає пошкодження білків, нуклеїнових кислот та ліпідів біологічних мембран. Радикали HO· володіють мутагенними, канцерогенними та цитостатичними властивостями. З іншого боку, реагуючи із ненасиченими жирними
17
кислотами, що входять до складу мембранних ліпідів, радикали гідроксиду ініціюють ланцюгову реакцію їх ПОЛ. Однак слід мати на увазі, що радикал гідроксиду має невеликий час життя і встигає дифундувати на незначну відстань, взаємодіючи при цьому лише із молекулами, які знаходяться поряд.
Активні форми нітрогену. У протіканні окисно-відновних реакцій клітин важливу роль відіграє система NO•, як регулятора багатьох ключових фізіологічних та біохімічних процесів. Встановлено активуючу дію NO• на розчинну форму важливого внутрішньоклітинного регулятора білку – гуанілатциклази. Активований фермент синтезує цГМФ – активний вторинний мессенджер, який регулює роботу мембранних іонних каналів, процеси фосфорилювання білків та інші реакції. У великій кількості NO• може мати токсичний ефект на клітину.
Показано, що цитотоксична дія NO• обумовлена його реакцією із супероксидом:
•N=O + •O-O- + H+  O=N-O-OH (пероксинітрит)
O=N-O-OH (пероксинітрит)
Пероксинітрит, що утворюється у цій реакції, може розкладатись з утворенням HO•:
O=N-O-OH 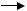 O=N-O• + HO• (радикал гідроксиду) Цитотоксичний ефект проявляється перш за все в інгібуванні активності мітохондріальних ферментів, що призводить до зниження утворення АТР, а також ферментів, які приймають участь у реплікації ДНК. Крім того, NO• та ONO2- можуть безпосередньо пошкоджувати ДНК. Це розглядається як однією із причин розвитку апоптозу. Сильні окислювачі NO• та ОNO2- - володіють високою реакційною здатністю, тому впливають на протікання ланцюгових вільнорадикальних
O=N-O• + HO• (радикал гідроксиду) Цитотоксичний ефект проявляється перш за все в інгібуванні активності мітохондріальних ферментів, що призводить до зниження утворення АТР, а також ферментів, які приймають участь у реплікації ДНК. Крім того, NO• та ONO2- можуть безпосередньо пошкоджувати ДНК. Це розглядається як однією із причин розвитку апоптозу. Сильні окислювачі NO• та ОNO2- - володіють високою реакційною здатністю, тому впливають на протікання ланцюгових вільнорадикальних
реакції.
Вільнорадикальне (пероксидне) окиснення ліпідів. Активні форми оксигену та нітрогену при взаємодії із ліпідами активують реакції пероксидного окиснення ліпідів. До активних сполук ліпідів відносяться – алкільні, алкоксильні та діоксил-радикали, а також гідропероксиди поліненасичених жирних кислот та відповідних ланцюгів фосфоліпідів, триацилгліцеролів чи холестеролу. Головні субстрати ПОЛ в клітині - поліненасичені ділянки жирних кислот (ліноленової, арахідонової тощо) фосфоліпідів, а кінцеві продукти – епоксиди, кетони, альдегіди.
Реакція пероксидного окиснення ліпідів протікає в декілька стадій: ініціювання, продовження, розгалуження та обрив ланцюга. Розглянемо ці стадії більш детально.

18
Ініціювання ланцюга. Вільний радикал (частіше радикал гідроксиду) проникає у ліпідний мембранний шар, оскільки це незаряджена та невелика за розміром частинка, та вступає в хімічну взаємодію із поліненасиченими жирними кислотами (LH), які входять до складу біологічних мембран. При цьому утворюються ліпідні радикали:
HO· + LH 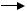 H2O + L·
H2O + L·
Ліпідний радикал (L·) вступає в реакцію із розчиненим молекулярним киснем, при цьому утворюється новий вільний радикал
– ліпопероксил (LOO·):
L· + O2 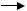 LOO·
LOO·
Продовження ланцюга. Утворений радикал атакує сусідню молекулу фосфоліпіду із утворенням LOOH та нового радикалу L·:
LOO· + LH 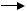 LOOH + L·
LOOH + L·
Послідовне повторення останніх реакцій і представляє собою ланцюгову реакцію пероксидного окиснення ліпідів.
Розгалудження ланцюга. Суттєве прискорення пероксидації ліпідів спостерігається у присутності невеликої кількості іонів двовалентного ферума. У цьому випадку відбувається розгалудження в результаті взаємодії Fe2+ із гідроперекисями ліпідів:
Fe2+ + LOOH 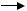 Fe3+ + HO- + LO·
Fe3+ + HO- + LO·
Радикали LO·, які утворюються, ініціюють нові ланцюги окиснення ліпідів:
LO· + LH 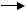 LOH + L·;
LOH + L·;
L· + O2 |
LOO· |
і т.д. |
Обрив ланцюга. Ланцюг може обриватись у результаті взаємодії вільних радикалів із антиоксидантами (InH), іонами металів перемінної валентності (наприклад, тими ж Fe2+) або один з одним:
LOO· + Fe2+ + H+ 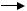 LOOH + Fe3+
LOOH + Fe3+
LOO· + InH |
In· + LOOH |
LOO· + LOO· |
молекулярні продукти + фотон |
19
Таким чином, процес ПОЛ – досить складний багатоетапний ланцюговий процес, в результаті протікання якого утворюється широкий спектр продуктів. Ключем до його запуску є вільні радикали, що реагують з поліненасиченими жирними кислотами. Це приводить до появи в складі останніх жирнокислотних радикалів. При проходженні електронного перегрупування неспарений електрон делокалізується – виникають дієнові кон’югати, які взаємодіють з киснем, в результаті чого утворюються пероксидні радикали. Поряд із радикалами та пероксидами в процесі ПОЛ утворюються вторинні продукти – альдегіди (малоновий діальдегід, 4-гідроксинонераль тощо), достатньо стабільні токсичні речовини – окислені лізоформи ліпідів (наприклад, лізофосфатидилхолін). Подальша взаємодія з аміновміщуючими сполуками: амінокислотами, білками, в тому числі й з ферментами, нуклеотидами, ДНК, РНК – призводить до утворення ліпофлуоресціюючих продуктів ( шифових основ), які накопичуються в організмі.
Таким чином, в результаті процесу пероксидації у ліпідному бішарі утворюються токсичні гідропероксиди, ліпопероксиди, епоксиди, альдегіди, кетони, лізоформи фосфоліпідів, вільні жирні кислоти тощо. Однак, лише деякі із них використовуються як кількісні індикатори процесу ПОЛ у біологічних мембранах ( табл.3.3).
Слід підкреслити, що у клітинах організму відбуваються оксидативні зміни і макромолекул геномної ДНК, причому опромінення призводить до активації цього процесу. Основні окислені основи ДНК (оксиаддукти) наведено на рис. 3.15-3.16.
Таблиця 3.3. Продукти ПОЛ та методи їх визначення
Продукти ПОЛ |
Методи визначення |
|
|
Вільнорадикальні продукти |
Хемілюмінісценція, ЕПР |
Гідроперекиси фосфоліпідів |
Полярографія, амперометрія |
Дієнові кон’югати |
УФ–спектрофотометрія |
|
|
Газоподібні продукти |
Газова хроматографія |
Карбонільні сполуки (альдегіди) |
Фотометрія |
Шифові основи |
Флуорометрія |
Більшість оксиаддуктів призводить до значних змін структури хроматину. Вони характеризуються цитотоксичністю, канцерогенністю та являються основою мутацій (див. далі).
Клітинні системи антирадикального захисту. Протікання окиснювальних процесів у клітинах знаходиться під контролем антиоксидантної системи (АОС) яку умовно поділяють на 3 частини:
