
Радіобіологія фул вершин (передмовалесс, вступлесс етс. едишн)
.pdf
|
|
|
|
30 |
опромінення змінюються |
пригніченням |
цих |
функцій |
та |
порушенням структури мембрани. |
|
|
|
|
4. Радіаційно - індукована модифікація ліпідного оточення |
Na,K- |
|||
АТФази призводить до |
змін її активності, |
а із |
цим пов’язані |
|
транспортні і, як результат, інші функціональні порушення життєдіяльності клітини.
5.Зростання надходження іонів кальцію до клітини стимулює активність фосфоліпаз та інші ферментні системи, які приймають участь у фосфоліпазному обміні. Зростання вільних жирних кислот та продукти ПОЛ модифікують мембрану, а значне зростання вільних іонів кальцію в клітині приводить до розвитку необоротних реакцій.
6.Модифікація клітинної поверхні призводить до змін рецепторної функції мембран, передачі та надходження сигналу до клітини.
ФОРМУВАННЯ РАДІАЦІЙНИХ ПОШКОДЖЕНЬ ДНК У КЛІТИНІ. Дія іонізуючих випромінювань на живі організми викликає пошкодження клітинних макромолекул, у тому числі ДНК, як шляхом прямої іонізації, так і непрямого впливу (при взаємодії вільних радикалів із ДНК). Пошкодження ДНК суттєво відрізняються у залежності від умов опромінення, а також від упаковки молекули ДНК у клітинних органелах. Кількість пошкоджень ДНК на одиницю дози при її опроміненні у розчині (іn vіtrо) приблизно в 60 - 100 раз більша у порівнянні із кількістю таких пошкоджень, що реєструються у ДНК опромінених клітин (іn vіvо). Тобто, частота порушень ДНК в більш відкритих ділянках хроматину може бути значно більшою. Радіаційний вихід пошкоджень ДНК лінійно залежить від дози опромінення, особливо для випромінювань із високою ЛПЕ.
Таблиця 3.6. Пошкодження ДНК у клітинах ссавців, які індуковані іонізуючою радіацією із низькою ЛПЕ
Тип пошкоджень |
Кількість пошкоджень |
|
в клітині на 1 Гр |
|
|
одноланцюгові розриви (ОР) |
1000 |
|
|
пошкодження основ |
500 |
|
|
зшивки ДНК-білок |
150 |
дволанцюгові розриви (ДР) |
40 |
Всі типи порушень ДНК в опроміненій клітині умовно підрозділяють на три групи. До першої відносяться одиночні (односайтові) пошкодження в кожній із ланцюгів двоспіральної молекули ДНК – одноланцюгові розриви (ОР), модифікація основ та
31
утворення лужно-лабільних ділянок. До другої групи, які призводять до просторових порушень ДНК, – множинні пошкодження (ОР на протилежних ланцюгах ДНК), дволанцюгові розриви (ДР), як результат ОР. До третьої – порушення надмолекулярної організації ДНК (зшивки ДНК-білок, ДНК-ДНК) (табл. 3.6).
Одиночні пошкодження ДНК. В утворенні одиночних
(односайтових) пошкоджень ДНК превалюють механізми непрямої дії радіації, а більшість цих пошкоджень ефективно репарується в організмі у післярадіаційний період. Однак, будь-які односайтові пошкодження у клітині потенційно можуть бути летальними, мутагенними та канцерогенними, оскільки здатні блокувати реплікативний синтез, приводять до помилкових вставок нуклеотидів при синтезі ДНК та порушують ДНК-білкові взаємодії.
Модифікація основ. Хімічна модифікація основ – кількісно одна із основних компонент радіаційного пошкодження ДНК. Переважна кількість цих модифікацій, які утворюються за умов γ-опромінення, обумовлена дією активних форм оксигену (переважно HO· та О2-∙) в оточенні ДНК. У водному оточенні основи ДНК більше піддаються дії радикалів, ніж цукри. Крім того, радіаційний вихід модифікованих основ у дволанцюгової ДНК у 3 рази вищий, ніж у одноланцюговій ДНК. Найбільш стабільні модифікації основ ДНК опромінених клітин наведено на рис. 3.15 та 3.16.
Важлива проблема при оцінці радіаційного виходу модифікованих основ – чутливість методів їх визначення. Наприклад, 8- гідроксипурин виникає у 700 випадках в ДНК однієї клітини за опромінення в дозі 1 Гр, що відповідає 1,1·10-14 моль/107 клітин. Це потребує використання складних методик, у тому числі і використання специфічних антитіл. На сьогодні, 8-гідроксигуанін розглядається як найбільш суттєвий маркер окиснювального пошкодження ДНК. Радіаційно-модифіковані модифікації основ в ДНК клітин у післярадіаційний період ефективно репаруються в основному за допомогою системи ексцизійної репарації основ.
Одноланцюгові розриви (ОР). ОР – одні із головних структурних пошкоджень ДНК, які індукуються іонізуючими випромінюваннями. Вони гетерогенні як по кінцевим групам, так і по швидкості післярадіаційної репарації.

32
|
O |
|
O |
|
|
HN |
CH3 |
HN |
|
CH2OH |
|
OH |
|
|
|
||
(2) |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
(3) |
||
|
H |
|
|
||
O |
O |
N |
|
|
|
N |
|
|
|||
|
|
|
|
||
|
dR |
|
dR |
O |
|
|
|
|
|
|
|
|
|
|
HN |
|
CH3 |
|
|
|
|
OH(H) |
|
|
O |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
HN |
CH3 |
|
O |
N |
H(OH) |
|
|
|
|
||
|
|
|
|
|
|
(1) |
|
|
|
dR |
(4) |
|
|
|
|
||
|
|
|
|
|
|
O |
N |
|
|
O |
|
|
|
|
|
||
|
|
HN |
|
|
|
|
dR |
|
|
|
|
|
|
O |
|
CH3 |
|
|
|
N |
OH |
(5) |
|
|
|
|
|||
|
O |
|
|
|
|
(6) |
H2N C NH |
dR |
|
|
|
|
|
|
|
||
|
|
O |
CHO |
|
|
|
|
H2N C |
N |
dR |
(7) |
|
O |
|
NH2 |
|
|
|
OH |
|
|
OH |
|
|
N |
|
|
|
|
HN |
|
|
|
|
|
H |
|
|
|
|
|
(9) |
|
|
(10) |
||
|
|
|
|||
H |
|
|
|
|
|
|
|
|
|
|
|
O |
OH |
O |
N |
|
|
N |
|
|
|
||
|
|
|
|
|
|
|
dR |
|
dR |
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
NH2 |
|
|
|
|
|
|
CO |
|
|
|
|
|
|
|
H |
|
N |
|
N |
|
OH |
|
(8) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(11) |
|
O |
N |
O |
|
O |
|
|
N |
|
|
|
|
|
dR |
dR |
|
|
|
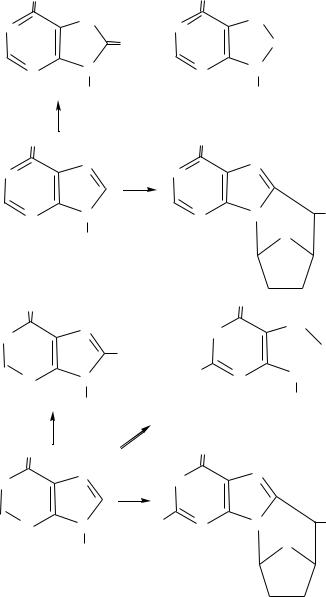
Рис. 3.15. Радіаційні модифікації піримідинів в складі ДНК:
1 – тимін, 2 – 5,6-дигідротимін, 3 – 5-гідроксиметилурацил, 4 – 5- гідрокси-5,6-дигідротимін (6-гідрокси-5,6-дигідротимін), 5 – 5- гідрокси-5-метилгідантоїн, 6 – сечовина, 7 - N'-формамідсечовина, 8 – цитозин, 9 – 5,6-дигідрокси-5,6-дигідроурацил, 10 – 5- гідроксицитозин, 11 – 3-карбоміл-4-гідроксигідантоїн. dR – дезоксирибоза.
NH2
N
(13)
N
NH2
N
(12)
N
O
HN
(17)
H2N 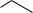 N
N
O
HN
(16)
H2N 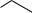 N
N
33
|
|
NH2 |
|
|
|
NH |
|
N |
|
NH |
|
|
|
|
|
|
|
|
O |
|
|
CHO |
|
N |
|
|
|
NH |
(14) |
|
N |
|
|
||
|
|
|
|
|
|
dR |
|
|
|
dR |
|
|
|
NH2 |
|
|
|
N |
|
N |
|
N |
(15) |
|
|
|
|
||
|
|
|
|
|
|
N |
|
N |
|
N |
O ~ |
|
|
|
|
|
|
dR |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
|
N |
|
HN |
|
NH |
|
|
|
|
|
||
|
|
|
|
|
|
|
OH |
|
|
|
CHO |
|
|
|
|
|
|
N |
|
H2N |
N |
NH |
(18) |
|
|
|
|
||
dR |
|
|
|
dR |
|
|
|
|
|
|
|
|
|
O |
|
|
|
N |
|
HN |
|
N |
|
|
|
|
|
||
|
|
|
|
(19) |
|
|
|
|
|
|
|
N |
H2N |
N |
|
N |
O ~ |
|
|
|
|
|
|
dR |
|
|
|
O |
|
|
|
|
|
|
Рис. 3.16. Радіаційні модифікації пуринів в складі ДНК:
12 – аденін, 13 – 8-оксо-7,8-дигідроаденін, 14 – 4,6-диаміно-5- формамідпіримідин, 15 – 8,5'-циклодезоксиаденозин, 16 – гуанін, 17 – 8-гідрокси-гуанін, 18 – 2,4-диаміно-6-окси-5-формамідпіримідин, 19
– 8,5'-циклодезоксигуанозин, dR – дезоксирибоза.
34
У формуванні ОР ДНК в опромінених клітинах провідну роль відіграють активні сполуки оксигену. Відношення кількості ОР до ДР ДНК за дії іонізуючих випромінювань у залежності від умов та типу опромінення лежить у межах 10-50. За дії радіації з великою щільністю іонізації частка ДР ДНК зростає.
Лужно-лабільні сайти. Лужно-лабільними сайтами називають такі структурні зміни в молекулі ДНК, які при зростанні рН середовища до лужних значень перетворюються у розриви полінуклеотидних ланцюгів. Вони можуть формуватись в результаті радіолізу чи вільнорадикального окиснення молекули дезоксирибози, а також деструкції та відщеплення основи. При цих пошкодженнях полінуклеотидні ланцюги не розриваються, однак, у випадку зростання рН середовища до лужних значень, виникають розриви ланцюгів у пошкоджених ділянках.
Локальні численні пошкодження. Утворення локальних численних пошкоджень (ЛЧП) на ділянках ДНК відіграє домінуючу роль у радіаційній загибелі, виникненні хромосомних, генних мутацій та неопластичної трансформації клітин. У переважаючих випадках
відбуваються вони у результаті прямої дії |
радіації. |
В основі |
механізмів, які ведуть до утворення ЛЧП, |
лежить |
виникнення |
кластерів пошкоджень в результаті проходження трека іонізації в локальному об’ємі ДНК чи пошкодження вільними радикалами менш захищених білками хроматину ділянок клітинної ДНК. Як результат – утворення різного виду пошкоджень, що включають дволанцюгові розриви (ДР) та ОР модифікацію основ тощо.
Дволанцюгові розриви (ДР) – утворюються в результаті ОР на протилежних ділянках ДНК. Таким чином, ЛЧП ДНК представляють собою комплексні пошкодження, які охоплюють ділянки більшої чи меншої довжини подвійної спіралі. Однак, можуть формуватись і одноланцюгові ділянки із порушенням вторинної структури ДНК. Поява таких ділянок обумовлена не тільки пошкодженням кількох основ, а і втратою олігонуклеотидів на одному із ланцюгів ДНК.
Щільноіонізуюча радіація викликає ЛЧП із великою кількістю односайтових кластерних пошкоджень та дволанцюгових поломок. Іонізуюче випромінювання з великою ЛПЕ індукує більше ДР чим рідкоіонізуюче. В компактно упакованих структурах хромосом кластерні порушення ДНК спостерігаються по всьому треку іонізації. Такі пошкодження можуть охоплювати обидва ланцюги подвійної спіралі та бути летальними для клітин, оскільки призводять до втрати певної частини генетичної інформації. Існує лінійна залежність
35
виходу ДР від дози опромінення клітин та можливість їх виникнення в результаті поглинання енергії одного трека іонізації на локальних ділянках ДНК.
Із усіх пошкоджень ДНК, що індукуються радіацією, ДР репаруються із найменшою швидкістю. Рівень ДР ДНК, що не репаруються, корелює із частотою хромосомних пошкоджень, загибеллю клітини та високою відносною біологічною ефективністю випромінення. ДР ДНК, які викликані щільноіонізуючою радіацією, репаруються важко чи із помилками в полінуклеотидах подвійної спіралі. Клітини ссавців, які не здатні відновлювати ДР ДНК, володіють високою радіочутливістю. У післярадіаційний період ЛЧП ДНК піддаються репарації в клітинах більш складними шляхами, чим односайтові пошкодження. Їх репарація обумовлена функціонуванням різних систем в залежності від типу та складності пошкодження.
Міжмолекулярні зшивки. Міжмолекулярних зшивок типу ДНКДНК відомо дуже мало. В біологічно значимих дозах вони формуються у незначній кількості. У клітинах частина молекул ДНК зв’язана із молекулами білку із утворенням ДНК-білкових зшивок. В результаті опромінення зростає кількість ковалентних ДНК-білкових зшивок. На їх утворення впливає щільність упаковки ДНК у складі хроматину ядер. Гістонові білки, на відміну від негістонових містять більше лізину та аргініну і мають позитивний заряд, що забезпечує їм електричну взаємодію із ДНК. Тому в опромінених клітинах спостерігається більше зшивок ДНК із гістонами. Радіаційний вихід ДНК-білок залежить від типу радіації – щільноіонізуюче випромінювання індукує більшу кількість таких зшивок.
З іншого боку, одним із ефектів, які спостерігаються при опроміненні клітин ссавців та бактеріальних клітин, є порушення зв’язків ДНК із клітинними елементами і, як результат, ДНК переходить у фракцію вільних молекул. Відомо, що значну роль в організації та функціонуванні генетичного апарату відіграють мембранні структури. Тому, радіаційно-індуковані порушення комплексу ДНК-мембрана може призвести до інактивації і, навіть, загибелі клітини. Досить мало досліджена післярадіаційна репарація ДНК-мембранного комплексу. Показано існування двох механізмів репарації: один з’єднує розриви субодиниць, а інший – відновлює зв’язки між субодиницями, із яких складається високомолекулярна ДНК.
Репарація ДНК в опроміненій клітині. Репарація ДНК - основа нормального функціонування клітини. У клітині кожну хвилину
36
виникає значна кількість спонтанних пошкоджень (більше ста тридцяти), які майже завжди репаруються. Додатково виникають пошкодження внаслідок, наприклад, опромінення.
Всі види ДНК-репараційних реакцій в опроміненій клітині умовно розділяють на два типи:
1) перший реалізується, коли пошкодження зачіпають один із ланцюгів ДНК, тоді інший – слугує матрицею для відновлення ДНК, як правило це спостерігається при малих дозах опромінення;
2) до другого відносяться репарації ДНК від дволанцюгових розривів, як правило це більш складний процес і не завжди можливий. Дволанцюгові розриви ДНК, що непаруються часто стають летальними для клітини.
Процес ферментативної репарації ДНК першого типу може протікати різними шляхами: шляхом елімінації пошкоджень із структури ДНК та шляхом їх обходу, коли пошкодження залишаються в структурі ДНК, але клітина ліквідує функціональні наслідки їх існування. У свою чергу, ліквідація пошкоджень у структурі ДНК може відбуватись шляхом обернених реакцій, що здійснюються впливом ферментів репарації на пошкоджені ділянки з їх подальшою ліквідацією, а також шляхом видалення пошкоджених ділянок із структури ДНК з подальшим відновленням вихідної структури ДНК (ексцизійна репарація ДНК). Під час проходження репарації ДНК шляхом обернених реакцій загальна кількість пошкоджень ДНК зменшується, водночас, під час ексцизійної репарації ДНК загальна кількість пошкоджень не змінюється, однак, ці пошкодження видаляються із структури ДНК. Ексцизійна репарація основ видаляє
із структури ДНК пошкодження, які |
виникають |
внаслідок |
||
дезамінування, |
метилювання |
чи |
утворення |
|
апуринових/апіримідинових |
сайтів. |
Ексцизійна |
репарація |
|
нуклеотидів дозволяє видаляти із структури ДНК пошкодження, які призводять до формування в ДНК виражених пошкоджень її вторинної структури.
Поряд із репарацією одноланцюгових розривів протікає репарація дволанцюгових розривів ДНК. Репарація дволанцюгових розривів може протікати безпомилково за участі механізму гомологічної рекомбінаційної репарації, під час якої використовується рекомбінаційний обмін пошкоджених ділянок з гомологічними ділянками ДНК в сестринських хроматидах. У клітинах ссавців репарація дволанцюгових розривів протікає за механізмом
негомологічного відновлення кінців ДНК, що часто супроводжується появою генетичних мутацій.
37
Таким чином, доля опроміненої клітини – загибель чи збереження життєздатності визначається не лише важкістю початкових пошкоджень, які залежать від дози опромінення її потужності, ЛПЕ, а також і від фізичного стану клітини, функціональної активності її ферментних систем, присутності радіопротекторів та радіосенсибілізаторів, фази клітинного циклу та інших факторів, які обумовлюють розвиток процесів біологічного посилення чи репарації радіаційних пошкоджень.
3.6. Дія іонізуючої радіації на системи та тканини живого організму
Органи та тканини живого організму відрізняються по своїй чутливості до дії іонізуючої радіації. Певна закономірність у розподіленні тканин по радіочутливості була сформульонана вченими Бергоньє та Трибондо (у 1906 р.), яка полягає у наступному: тканина характеризується більшою радіочутливістю, із зростанням проліферативної активності складаючих її клітин, а радіорезистентністю – із збільшенням ступеню їх диференціювання (правило Бергоньє - Трибондо).
Існуючий на сьогодні термін „радіочутливість״, який використовується як синонім „радіоураження״ по-відношенню до тканин не зовсім коректний. Так, непроліферуючі, високодиференційовані нервові клітини (нейрони) дорослого організма вважаються високорезистентними. Однак, що стосується функціонального стану, то показана висока реактивність елементів нервової системи на дію іонізуючих випромінювань. Крім того, необхідно враховувати опосередкований вплив з боку інших уражених радіацією тканин, а також порушення функцій регулюючих систем.
За морфологічними ознаками по ступеню зниження радіочутливості різні органи та тканини організму розміщуються у наступній послідовності:
1)органи кровотворення;
2)статеві золози;
3)слизові оболонки, слинні, потові та сальні залози, епідерміс;
4)шлунково-кишковий тракт;
5)печінка;
6)органи дихання;
7)залози внутрішньої секреції (наднирники, гіпофіз, щитоподібна залоза, підшлункова залоза, паращитовидна залоза);
38
8)органи виділення;
9)м’язова та сполучна тканини;
10)кісткова та хрящова тканини;
11)нервова тканина.
Органи кровотворення - найбільш радіочутливі, ушкодження кісткового мозку, тимуса, селезінки, лімфатичних вузлів – один із важливих проявів гострої променевої хвороби (див. розділ 4). Найбільш важливим результатом ураження цих органів, що
призводить до змін морфологічного складу |
периферійної крові |
- це |
їх клітинне спустошення. Післярадіаційні |
зміни кількості клітин |
|
різного типу периферійної крові у ссавців та людині подібні, |
тобто |
|
залежать від дози опромінення та мають багатофазний характер у часі після радіаційного впливу. Виділяють 3 фази у змінах клітинного складу крові: 1) рання дегенеративна; 2) максимальне зниження числа клітин; 3) регенерація. Вираженість та час прояву цих фаз після опромінення залежать від поглиненої дози іонізуючого опромінення. Після опромінення у низьких та середньолетальних дозах спустошення менш значне, а відновлення стійке. При смертельних дозах зниження вмісту клітин різке, раннє, глибоке, відновлення може розпочатись, але не завершується, оскільки наступає загибель.
В залежності від ступеня зрілості всі клітини системи крові та кровотворних органів поділяються на 4 пули: 1) стовбурові клітини; 2) клітини, що діляться та дозрівають; 3) клітини, які вже не діляться, але дозрівають; 4) зрілі клітини периферійної крові. Найбільша радіочутливість відмічена для стовбурових клітин (D0 від 1,5 до 1,9 Гр). Частина стовбурових клітин втрачає проліферативну активність практично відразу після опромінення. Радіочутливість клітин знижується по мірі зрілості клітин. Зрілі клітинні елементи крові
(лейкоцити, тромбоцити та еритроцити) відносно стійкі до дії іонізуючої радіації (D0 > 15 Гр), а зміни їх вмісту у крові після опромінення пов'язано лише з природним процесом зниження вмісту після завершення життєвого цикла та відсутності надходження до периферійної крові нових зрілих клітин.
Зміни кількості лейкоцитів – характерна реакція на променеву дію. Причому ці зміни мають фазовий характер, а ступінь зміни їх кількості знаходиться у прямій залежності від дози опромінення. Вміст еритроцитів після опромінення зменшується повільно та помірно, оскільки термін життя цих клітин складає приблизно 100 днів. Навіть за повної відсутності їх утворення, кількість еритроцитів
39
крові внаслідок природного відмирання знижується приблизно на 1 % за добу.
За променевої патології спостерігаються морфологічні зміни білої крові, гіперсегментування, фрагментація ядер. Лейкоцити набухають, зростають їх розміри та зернистість, накопичуються пігменти, структура ядра розрихляється тощо. Поряд із зниженням кількості нейтрофілів зменшується кількість тромбоцитів, що призводить до зростання терміну згортання крові. Клітини крові та її плазма відносно стійка до дії випромінювань. Біохімічні зрушення в крові тварин виявляються лише за розпалу променевого ураження, яка поступово втрачає здатність постачати тканини достатньою кількостю кисню.
Лімфоцити відносяться до найбільш радіочутливих клітин організму, а їх загибель відмічається уже за опромінення у десятих долях грея. При цьому гинуть не тільки молоді клітини, що діляться, але і зрілі лімфоцити, які за звичайних умов не діляться. З інтерфазною загибеллю зрілих популяцій лімфоцитів крові протягом першої доби після опромінення пов'язаний швидкий розвиток лимфопенії. Радіочутливість В-лімфоцитів вища, ніж Т-лімфоцитів, а радіаційна стійкість Т-супресорів дещо більша, ніж Т-хелперів. Крім того, серед Т-лімфоцитів існує відносно невелика популяція радіаційно стійких клітин, які зберігають свою функціональну активність після опромінення у відносно високих дозах (6 - 10 Гр чи навіть до 20 Гр), які, можливо, представляють собою Т-клітини пам'яті. Загибель лімфоцитів після опромінення відбувається як в лімфоїдних органах (тимус, лімфатичні вузли, селезінка), так і в периферійній крові та лімфі. Зниження рівня лімфоцитів, як і інших клітин периферійної крові, прямо залежить від дози опромінення.
Дія радіацій на лімфоїдну тканину може призвести не тільки до загибелі лімфоцитів, але викликає значні зміни їх функціональної активності. Це, у свою чергу, може вплинути на імунну відповідь у післярадіаційний період. Так, уже в найближчі хвилини-години після опромінення як для В-лімфоцитів, так і особливо для Т-лімфоцитів, характерним є втрата рецепторів для різних антигенів на клітинній поверхні. Крім того, значно знижується здатність В-лімфоцитів до вироблення специфічних імуноглобулінів у відповідь на антигенну стимуляцію.
Один із важливих аспектів дії іонізуючих віпромінювань на імунну систему - це їх вплив на систему цитокинів - продуктів активованих клітин імунної системи, які відіграють важливу роль в регуляції гемопоеза та міжклітинної взаємодії у процесі розвитку запалення та
