
- •Курс лекций
- •Технологии наноэлектроники
- •Молекулярно-лучеваяэпитаксия.
- •Газофазная эпитаксия из металлоорганических соединений.
- •Нанолитография.
- •Разрешающая способность.
- •Оптическая литография.
- •Рентгеновская литография.
- •Электронная литография.
- •Ионная литография.
- •Возможности методов литографии в наноэлектронике.
- •Нанопечатная литография.
- •Процессы травления в нанотехнологии.
- •Процессы самосборки повторяющихся структур.
- •Самосборка в объемных материалах.
- •Самосборка при эпитаксии.
- •Пленки пористых материалов.
- •Пленки пористого кремния.
- •Пленки пористого оксида алюминия.
- •Пленки поверхностно-активных веществ.
- •Основные определения и механизмы.
- •Осаждение пленок пав.
- •Пленки на основе коллоидных растворов.
- •Основные определения и свойства.
- •Золь-гель технология.
- •Методы молекулярного наслаивания и атомно-слоевой эпитаксии.
- •Зондовые нанотехнологии.
- •Физические основы зондовой нанотехнологии.
- •Контактное формирование нанорельефа.
- •Бесконтактное формирование нанорельефа.
- •Локальная глубинная модификация поверхности.
- •Межэлектродный массоперенос.
- •Электрохимический массоперенос.
- •Массоперенос из газовой фазы.
- •Локальное анодное окисление.
- •Стм-литография.
- •Методы исследования наноструктур.
- •Сканирующая зондовая микроскопия.
- •Сканирующая туннельная микроскопия.
- •Атомно-силовая микроскопия.
- •Ближнепольная сканирующая оптическая микроскопия.
- •Масс-спектроскопия атомов и молекул.
- •Определения и возможности.
- •Конструкции масс-анализаторов.
- •Вторично ионная масс-спектроскопия.
- •Электронные микроскопы.
- •Просвечивающие электронные микроскопы.
- •Растровые электронные микроскопы.
- •Метод дифракции медленных электронов (дмэ).
- •Метод дифракции отраженных быстрых электронов (добэ).
- •Оже-электронная спектроскопия.
- •Фото-электронная спектроскопия.
- •Полевая эмиссионная микроскопия.
- •Эллипсометрия.
- •Конфокальная сканирующая оптическая микроскопия.
- •Радиоспектроскопия.
- •Электронный парамагнитный резонанс.
- •Ядерный магнитный резонанс.
- •Ядерный квадрупольный резонанс.
- •Рентгено-структурный анализ.
- •Метод Лауэ.
- •Метод Дебая-Шеррера.
- •Компьютерный метод дш.
Электрохимический массоперенос.
Электрохимический массоперенос представляет собой технологический процесс электросаждения атомных слоев металла на подложку с помощью туннельного микроскопа.
Электрохимический массоперенос осуществляется с помощью электрохимического сканирующего туннельного микроскопа. Его отличительной особенностью является то, что зонд и подложка погружены в электролит. С помощью петли обратной связи зонд удерживается на расстоянии до микрометра за счет сохранения постоянства тока Фарадея в электролите.
Масса осажденного металла определяется из первого закона Фарадея, в соответствии с которым масса металлического осадка М за время процесса t определяется из формулы
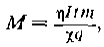
где η— токовая эффективность массопереноса, 1 — ток в цепи, т — масса ионов, χ— кратность ионизации иона, q — заряд электрона.
Методом электрохимического массопереноса проводят осаждение пленок серебра на проводящие подложки из пленок полимерных ионных проводников, а также формирование элементов металлического рисунка на внешней поверхности полимера.
Массоперенос из газовой фазы.
Массоперенос из газовой фазы представляет собой технологический процесс формирования пленок из газовой фазы металлоорганических соединений с помощью сканирующего туннельного микроскопа.
В основе этой технологии лежат процессы разложения газообразных металлсодержащих соединений в зазоре между зондом и подложкой и последующее локальное формирование металлических пленок. Разложение происходит в процессе неупругого рассеяния электронов, эмитированных острием. Возможен также процесс осаждения металлических пленок, связанный с образованием микроплазмы между зондом сканирующего электронного микроскопа и подложкой.
Технологией массопереноса из газовой фазы были осаждены пленки кадмия из газа диметила кадмия, вольфрама из гексакарбонила вольфрама, золота из диметилтрифторацетилацетоната золота и др. Давление газа находилось в пределах 60 - 250 Па, напряжение отрицательной полярности на зонде составляло 30 - 40 В, эмиссионный ток в пределах 5 нА. Создавались локальные участки металлизации с характерным размером 10 нм.
Существует также процесс, в котором потоком электронов инициируется травление материала предварительно осажденной тонкой пленки в среде активного (как правило, галогенсодержащего) газа. Локальная обработка здесь уже идет по материалу, полученному отдельно в заданных условиях, а значит, и с желаемыми свойствами.
Первые результаты для СТМ были получены при травлении кремнии в парах WF4 при давлениях 1.33∙102 Па -3.99∙103 Па. Игла СТМ при этом находилась под напряжением от -15 В до -20 В, размер протравленных элементов составил около 20 нм.
Заметим, что металлоорганика и металлгалогены являются весьма токсичными и поэтому требуют специальных мер защиты.
Локальное анодное окисление.
Локальное анодное окисление представляет собой технологический процесс трансформации проводящих подложек путем их окисления в диэлектрические структуры с одновременной визуализацией и контролем формирующихся структур.
В обычных атмосферных условиях поверхности, как правило, покрыты пленкой из нескольких монослоев адсорбата, основу которой составляет вода. В процессе стимулирования током зонда атомного силового микроскопа под зондом образуется мениск (рис. 2.34). Под острием формируется на- ноячейка, в которой происходит окисление поверхности подложки.
Процесс анодного окисления происходит в результате протекания следующих цепных реакций на аноде:
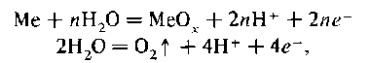
на катоде

В зазоре устанавливается равновесие:
![]()
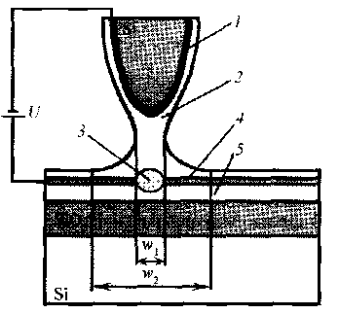
Рис. 2.34. Схема процесса локального анодного окисления титана: 1 - проводящее покрытие кантилевера; 2 - слой адсорбата: 3 — анодный оксид, 4 — собственный оксид титана; 5 — титановая пленка.
На процесс зондового окисления существенное влияние оказывает адсорбционно-десорбционный баланс в наноячейке.
Реакции свидетельствуют о значительном потреблении воды в ходе анодного окисления.
Толшина образующегося оксида зависит от приложенного потенциала и длительности процесса и может быть определена из уравнения
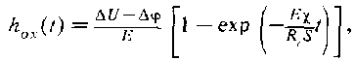
где ΔU — прикладываемая к наноячейке разность потенциалов, Δφ - скачки потенциала в электрохимической цепи, Ес — напряженность электрического поля, χ — электрохимический эквивалент окисления пленки, R -сопротивление цепи, S — площадь окисленной поверхности, t - время.
Пример формирования окисленных участков на поверхности пленки титана приведен на рис. 2.35. Окисление проводилось зондом атомно-силового микроскопа при потенциале 10 В и длительностью процесса от 10 до 1000 мс.
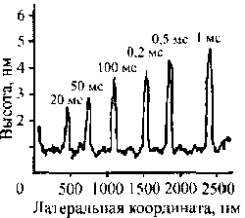
Рис. 2.35. Распределение высоты рельефа оксидных линий на поверхности титановой пленки в перпендикулярном линиям сечении. Три последние цифры в секундах.
Окисленные участки титановой пленки удалось визуализировать вследствие их разбухания. Разбухание пленки связано с окислительным процессом и переходом кристаллической структуры титановой пленки в аморфное состояние. В зависимости от времени процесса окисления меняется высота окисленной пленки (рис. 2.35).
С помощью специального программного обеспечения можно создавать векторные рисунки с одновременным формированием наноструктур. Обеспечена ширина оксидной пленки 8 - 10 нм. С помощью такой технологии можно создавать тонкие туннельно-прозрачные барьеры, одноэлектронные приборы и другие типы наноприборов.
