
- •Вопрос 5
- •6.2-Й закон термодинамики. Энтропия. Направление протекания химической реакции.
- •7.Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчет энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
- •10. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
- •15.Растворы электролитов. Катионы анионы.
- •16.Каков механизм диссоциации солей в растворах или расплавах
- •18.Слабые электролиты. Константа и степень диссоциации
- •19.Вода как слабый электролит.Индикаторы.
- •20.Сущность гидролиза солей.
- •21.Гидролиз солей.
- •22.Константа гидролиза
- •1.Природа соли
- •2. Концентрация соли
- •3. Температура
- •4. Присутствие одноименных ионов
- •23.Химическая связь в комплексных соединениях и их строение
- •24. Диссоциация комплексных соединений с комплексным анионом и комплексным катионом. Константа нестойкости комплексного иона. Номенклатура комплексных соединений. Двойные соли.
- •25. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчета степени окисления. Высшая низшая и средняя степень окисления.
- •26.Важнейшие окислители. Важнейшие восстановители.
- •27.Классификация окислительно-восстановительных реакция (привести примеры, составить уравнения реакции)
- •29.1.Стандартный электродный потенциал металла (е0)
- •2.Ряд напряжений
- •31.Сущность коррозийных поцессов.
20.Сущность гидролиза солей.
|
Соли, реагирующие с водой |
Сокращенные ионные, полные ионные и молекулярные уравнения реакций |
Среда раствора |
|
Хлорид натрия |
H2O Na+ +
Cl– +
H2O NaCl
+ H2O |
Нейтральная |
|
Kарбонат натрия |
2Na+ + Na2CО3 +
H2O |
Щелочная |
|
Хлорид алюминия |
Al3+ +
НОН Al3+ +
3Cl– +
H2O AlCl3 +
H2O |
Kислая |
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли становится кислотным или щелочным соответственно.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония NH4Cl.
![]()
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
![]()
2) полная диссоциация соли (сильного электролита):
![]()
Образующиеся при этом ионы OH- и NH4+ взаимодействуют между собой с получением NH3 · H2O(слабый электролит), тогда как ионы Н+ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
![]()
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т. к. вода Н2О — значительно более слабый электролит, чем гидрат аммиака NH3 · H2O.
Сокращенное ионное уравнение гидролиза:
![]()
Уравнение показывает, что:
1) в растворе есть свободные ионы водорода Н+, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (рН < 7);
2) в реакции с водой участвуют катионы аммония NH4+; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные М2+ (например, Ni2+,Cu2+, Zn2+...), кроме катионов щелочноземельных металлов, трехзарядные М3+(например, Fe3+,Al3+, Cr3+...).
Рассмотрим гидролиз нитрата никеля Ni(NO3)2.
![]()
Происходит гидролиз соли по катиону Ni2+.
Полное ионное уравнение гидролиза:
![]()
Сокращенное ионное уравнение:
![]()
Продукты гидролиза — основная соль NiOHNO3 и азотная кислота HNO3.
Среда водного раствора нитрата никеля кислотная (рН < 7), потому что в растворе увеличивается концентрация ионов Н+.
Гидролиз соли NiOHNO3 протекает в значительно меньшей степени, и им можно пренебречь. Таким образом:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН < 7);
4) при гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
3. Соли, образованные слабым основанием и слабой кислотой.
Такие соли подвергаются гидролизу и по катиону, и по аниону.
ЗАПОМНИ. Возможность и характер протекания гидролиза определяется природой основания и кислоты, из которых образована соль.
Катион слабого основания связывает ионы ОН- из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы Н+ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов — кислоты и основания, которые образуются в результате гидролиза.
Например, рассмотрим гидролиз двух солей: ацетата аммония NH4CH3COO и формиата аммонияNH4HCCO:
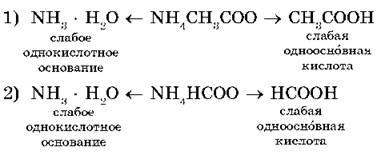
В водных растворах этих солей катионы слабого основания NH4+ взаимодействуют с гидроксид-ионами ОН- (напомним, что вода диссоциирует ), а анионы слабых кислотCH3COO- и HCOO- взаимодействуют с катионами Н+ с образованием молекул слабых кислот — уксусной CH3COOH и муравьиной HCOOH.
Запишем ионные уравнения гидролиза:
![]()
В этих случаях гидролиз тоже обратимый, но равновесие смещено в сторону образования продуктов гидролиза — двух слабых электролитов.
В первом случае среда раствора нейтральная (рН = 7), т. к. КД(СН3СООН) = KД(NH3 · H2O) = 1,8 · 10-5. Во втором случае среда раствора будет слабокислотной (pH < 7), т. к. КД(НСООН) = 2,1 · 10-4и KД(NH3 · Н2О) < КД(НСООН), где КД — константа диссоциации.
Гидролиз большинства солей является обратимым процессом. В состоянии химического равновесия гидролизована лишь часть соли. Однако некоторые соли полностью разлагаются водой, т. е. их гидролиз является необратимым процессом.
Сульфид алюминия Al2S3 в воде подвергается необратимому гидролизу, т. к. появляющиеся при гидролизе по катиону ионы Н+ связываются образующимися при гидролизе по аниону ионами ОН-. Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
![]()
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, хлорида алюминия AlCl3 и сульфида натрия Na2S.
В результате гидролиза и по катиону, и по аниону:
1) если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующихся основания и кислоты;
2) соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
