
- •Вопрос 5
- •6.2-Й закон термодинамики. Энтропия. Направление протекания химической реакции.
- •7.Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчет энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
- •10. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
- •15.Растворы электролитов. Катионы анионы.
- •16.Каков механизм диссоциации солей в растворах или расплавах
- •18.Слабые электролиты. Константа и степень диссоциации
- •19.Вода как слабый электролит.Индикаторы.
- •20.Сущность гидролиза солей.
- •21.Гидролиз солей.
- •22.Константа гидролиза
- •1.Природа соли
- •2. Концентрация соли
- •3. Температура
- •4. Присутствие одноименных ионов
- •23.Химическая связь в комплексных соединениях и их строение
- •24. Диссоциация комплексных соединений с комплексным анионом и комплексным катионом. Константа нестойкости комплексного иона. Номенклатура комплексных соединений. Двойные соли.
- •25. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчета степени окисления. Высшая низшая и средняя степень окисления.
- •26.Важнейшие окислители. Важнейшие восстановители.
- •27.Классификация окислительно-восстановительных реакция (привести примеры, составить уравнения реакции)
- •29.1.Стандартный электродный потенциал металла (е0)
- •2.Ряд напряжений
- •31.Сущность коррозийных поцессов.
16.Каков механизм диссоциации солей в растворах или расплавах
Представьте, что будет с хорошо знакомой всем людям поваренной солью, если ее кристаллы расплавить или бросить в воду. Это вещество имеет структуру ионной кристаллической решетки. При расплавлении тепловая энергия приведет к тому, что колебания ионов в узлах решетки многократно усилятся, в результате чего связи между соседними ионами начнут разрушаться. Появятся свободные ионы. И этот процесс при продолжении нагрева будет продолжаться до полного разрушения кристаллической решетки. Аналогичный механизм разрушения будет и при растворении кристаллов поваренной соли в воде, только вместо тепловой энергии тут действуют молекулы воды, как бы «растягивающие» кристаллы на отдельные частицы. Впервые теория электролитической диссоциации была выдвинута двумя химиками – Аррениусом и Оствальдом в конце XIX века. Именно с помощью диссоциации описывают свойства солей, а также оснований и кислот. Кислые и основные соли проходят диссоциации ступенчато, например, KHSO4 =K^+ + HSO4^-
Каковы особенности диссоциации солей
При диссоциации солей образуются положительно заряженные катионы металлов (либо катион аммония), а также отрицательно заряженные катионы кислотных остатков. Процесс диссоциации идет в зависимости от того, какая соль подвергается растворению или расплавлению (средняя, кислая или основная). Если соль средняя (то есть, образованная кислотой, в молекулах которой все катионы водорода замещены катионами металла, или аммония), диссоциация происходит по таким схемам, в одну стадию: КNO3=K^++NO3^- Na2SO4=2Na^++SO4^2- Кислые и основные соли диссоциируют в несколько стадий. Кислая соль (то есть образованная кислотой, катионы водорода которой замещены не полностью) сначала теряет металлический ион, а затем отщепляется катион водорода. Например: NaHSO4=Na^++HSO4^- HSO4^-=H^++SO4^2- У основных же солей (то есть образованных щелочами, у которых не полностью замещены гидроксил-группы), сначала отщепляются кислотные остатки, а потом ОН^- -ионы. Например: Cu(OH)Cl = Cu(OH)^++Cl^- Cu(OH)^+ = Cu^2++OH^- Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например,
HNO3 « H+ + NO3–
Многоосновные кислоты диссоциируют ступенчато. Например сероводородная кислота диссоциирует ступенчато:
H2S « H+ + HS– (первая ступень)
HS– « H+ + S2– (вторая ступень)
Диссоциация многоосновных кислот протекает, главным образом, по первой ступени. Это объясняется тем, что энергия, которую нужно затратить для отрыва иона от нейтральной молекулы , минимальна и становится больше при диссоциации по каждой следующей ступени.
Основаниями называются электролиты, диссоциирующие в растворе, которые в качестве анионов образуют только гидроксид-ионы. Например,
NaOH ® Na+ + OH–
Многокислотные основания диссоциируют ступенчато
Mg(OH)2 « MgOH+ + OH– (первая ступень)
MgOH+ « Mg2+ + OH– (вторая ступень)
Ступенчатая диссоциация кислот и оснований объясняет образование кислых и основных солей.
Существуют электролиты, которые диссоциируют одновременно как основные и как кислотные. Они называются амфотерными.
H+ + RO– « ROH « R+ + OH–
Амфотерность объясняется малым различием прочности связей R–H и О–Н.
К амфотерным электролитам относятся вода, гидроксиды цинка, алюминия, хрома (III), олова (II, IV), свинца (II, IV) и др.
Диссоциацию амфотерного гидроксида, например Sn(OH)2, можно выразить уравнением:
2H+ + SnO22– « Sn(OH)2 « Sn2+ + 2OH–
+2H2O ¯ основные свойства
2H+ + [Sn(OH)4]2– кислотные свойства
Для многоосновных кислот и многокислотных оснований характернаступенчатая диссоциация с отрывом одного нона Н+ или ОН по каждой ступени. Таким образом, число ступеней определяется основностью кислоты иликислотностью основания. Поскольку первый ион отрывается от нейтральной частицы, а последующие от частиц с зарядом противоположного знака, который увеличивается с каждой ступенью на единицу, то степень электролитической диссоциации сильно уменьшается при переходе от первой ступени к каждойследующей. Примером может быть фосфорная кислота при с=0,1 моль/л
17.Сильные электролиты. Активность ионов
Сильными электролитами называются такие электролиты, степень диссоциации которых в растворах равна единице (т.е. диссоциируют полностью) и не зависит от концентрации раствора. К ним относятся большинство солей, которые уже в кристаллическом состоянии построены из ионов, гидроксиды щелочных и щелочноземельных металлов, некоторые кислоты (НСl, HBr, HI, HClO4, HNO3).
В растворах сильных электролитов концентрация ионов довольно велика, так что силы межионного взаимодействия заметно проявляются даже при малой концентрации электролита. В результате ионы оказываются не вполне свободными в своем движении, и все свойства электролита, зависящие от числа ионов, проявляются слабее, чем следовало бы ожидать при полной диссоциации электролита на не взаимодействующие между собой ионы. Поэтому для описания состояния ионов в растворе пользуются, наряду с концентрацией ионов, их активностью, т.е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией в растворе С соотношением
a = fC
где f - коэффициент активности иона (безразмерная величина).
Коэффициенты активности ионов зависят от состава и концентрации раствора, от заряда и природы лона и от других условий. Однако в разбавленных растворах (С ? 0,5 моль/л) природа иона слабо сказывается на величине его коэффициента активности. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона в данном растворителе зависит только от заряда иона и ионной силы раствора I, которая равна полусумме произведений концентрации С каждого иона на квадрат его заряда z:
I=0,5 (С1 z12 + С2 z22 + …+ Сn zn2) =0,5 Сi z i2
В табл.1 приведены значения коэффициентов активности ионов в разбавленных растворах в зависимости от их заряда и ионной силы раствора. Приближенно коэффициент активности иона в разбавленном растворе можно также вычислить по формуле: lg f = - 0,5z2 - .
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
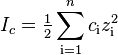 ,
,
где ci — молярные концентрации отдельных ионов (моль/л), zi - заряды ионов
