
- •Вопрос 5
- •6.2-Й закон термодинамики. Энтропия. Направление протекания химической реакции.
- •7.Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчет энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
- •10. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
- •15.Растворы электролитов. Катионы анионы.
- •16.Каков механизм диссоциации солей в растворах или расплавах
- •18.Слабые электролиты. Константа и степень диссоциации
- •19.Вода как слабый электролит.Индикаторы.
- •20.Сущность гидролиза солей.
- •21.Гидролиз солей.
- •22.Константа гидролиза
- •1.Природа соли
- •2. Концентрация соли
- •3. Температура
- •4. Присутствие одноименных ионов
- •23.Химическая связь в комплексных соединениях и их строение
- •24. Диссоциация комплексных соединений с комплексным анионом и комплексным катионом. Константа нестойкости комплексного иона. Номенклатура комплексных соединений. Двойные соли.
- •25. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчета степени окисления. Высшая низшая и средняя степень окисления.
- •26.Важнейшие окислители. Важнейшие восстановители.
- •27.Классификация окислительно-восстановительных реакция (привести примеры, составить уравнения реакции)
- •29.1.Стандартный электродный потенциал металла (е0)
- •2.Ряд напряжений
- •31.Сущность коррозийных поцессов.
1.Предмет и значение химии для современного инженера строителя. Роль химии в современной промышленности, науке передовых технологиях. Химия и энергетика. Химия и продовольствие. Современное строительство использует великое множество самых разнообразных строительных материалов, из которых при помощи определенных строительных технологий и строится здание или сооружение.Так же как и в остальных отраслях жизнедеятельности человека, в строительстве основой являются физические, химические и электрические законы природы.Поэтому при возведении здания учитываются самые разнообразные химические и физические процессы, которые проистекают в материалах при строительстве, сразу же после него или в процессе эксплуатации здания. Строительный проект будущего здания или сооружения должен быть ориентирован, в том числе и на использование материалов, наиболее подходящих для данного климата, для данной местности, а также максимально ориентированного на экологическую чистоту и безопасность Химические процессы играют важную роль в современном строительстве. Это состав, приготовление, а также преобразования веществ и происходящие при этом процессы.Каждое тело, будь оно твердым, жидким или даже газообразным, занимает определенное пространство и вытесняет из него другие вещества. Каждое тело состоит из вещества, материи. В свою очередь вещество, занимая определенное пространство, также является телом. Свойства тел включают в себя форму агрегатного состояния, объем и энергетическое состояние. Свойства веществ включают в себя способность реакции с другими веществами, запах, вкус, устойчивость к коррозии, устойчивость к теплу и холоду. Строительная химия занимается составом и химическими свойствами веществ, а также изменениями этих свойств при химических процессах.
Во все времена химия служит человеку в его практической деятельности. Еще в древности возникли ремесла, в основе которых лежали химические процессы: получение металла, стекла, керамики, красителей. Большую роль играет химия в современной промышленности. Химическая и нефтехимическая промышленность являются важнейшими отраслями, без которых невозможно функционирование экономики. Среди важнейших продуктов химии следует назвать кислоты, щелочи, слои, минеральные удобрения, растворители, масла, пластмассы, каучуки и резины, синтетические волокна и многое другое. В настоящее время химическая промышленность выпускает несколько десятков тысяч наименований продукции. Исключительно важную роль играют химические продукты и процессы в энергетике, которая использует энергию химических реакций. Для энергетических целей используются многие продукты переработки нефти (бензин, керосин, мазут) , каменный и бурый уголь, сланц и торф. В связи с уменьшением природных запасов нефти вырабатывается синтетическое топливо путем химической переработки различного природного сырья и отходов производства. Развитие многих отраслей промышленности связано с химией: металлургия, машиностроение, транспорт, промышленность строительных материалов, электроника, легкая, пищевая промышленность- вот неполный список отраслей экономики, широко использующих химические продукты и процессы. Во многих отраслях применяются химические методы, например, катализ (ускорение процессов) , химическая обработка металлов, защита металлов от коррозии, очистка воды. Большую роль играет химия в развитии фармацевтической промышленности: основную часть всех лекарственных препаратов получают синтетическим путем. Исключительно большое значение химия имеет в сельском хозяйстве, которое использует минеральные удобрения, средства защиты растений от вредителей, регуляторы роста растений, химические добавки и консерванты к кормам для животных и другие продукты. Использование химических методов в сельском хозяйстве привело к возникновению ряда смежных наук, например, агрохимии и биотехнологии, достижения которых в настоящее время широко применяются в производстве сельскохозяйственной продукции.
2.Основные понятия химической стехиометрии(моль,молярная масса,эквивалент,эквивалентная масса)Определение эквивалентов и эквивалентных масс.
Раздел химии в котором иследуется количественный состав соеденений а также количественные изменения протикающих в химических реакциях.
Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой0,012 кг. Количество специфицированных структурных элементов в одном моле вещества называется постоянной Авогадро (числом Авогадро), обозначаемой обычно какNA. Таким образом, в углероде-12 массой 0,012 кг содержится NA атомов. Значение постоянной Авогадро равно 6,02214129(27)•1023 моль−1. Моля́рная ма́сса вещества физ. величина, равная отношению массы к кол-ву в-ва. Единица М. м. (в СИ) - кг/моль. М = m/n, где М - М. м. в кг/моль, m - масса в-ва в кг, п - кол-во в-ва в молях.
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-основных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакцияхПод эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число мольвещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции. Эквивалентная масса — это масса одного эквивалента данного вещества
. Оксиды , основания, кислоты и соли – это важнейшие классы неорганических соединений. Оксиды делятся на две группы: солеобразующие(делятся на основные, кислотные, амфотерные).инесолеобразующие((безразлич-ные, индеферентныеСО, SiO2, N2O, NO).Кислоты по наличию кислорода делятся на кислородные и безкислородные Основания (гидроксиды) - сложные вещества, в состав которых входят атомы металлов (катионов) и одна или несколько гидроксильных групп - Ме(ОН) .(по растворимости в водебывают(растворимые малорастворимые нерастворимые)ипо количеству групп OH(однокислотные,двухкислотные,многокислотные) Кислоты В зависимости от числа атомов водорода в молекуле кислоты, способных замещаться на ме¬талл, кислоты делятся на одно- и многоосновные. По составу кислотные остатки делятся на кислородсодержащие и бескислородные. Соли - это продукты полного или частичного замещения атомов водорода в кислоте на атомы металла или гидроксогрупп в основании на кислотные остатки. В случае полного замещения образуются сред¬ние (нормальные соли). В случае частичного замещения получаются кислые и основные соли.
Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества. По определению эквивалент вещества - это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений. Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений (мы будем рассматривать только неорганические соединения)
mэкв(оксида) = Моксида/(число атомов кислорода•2);
mэкв(основания) = Моснования/кислотность основания;
mэкв(кислоты) = Мкислоты/основность кислоты;
mэкв(соли) = Мсоли/(число атомов металла•валентность металла).
Можно отметить, что в большинстве случаев кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
3.Количественные законы химии. Закон эквивалентов. Состав химических соединений и изменения их состава, происходящие в результате химических реакций, подчиняются четырем важнейшим законам. Они называются количественными законами химии.
Закон сохранения материи (Лавуазье, 1774 г.) *. Согласно этому закону, в химических реакциях не может происходить возникновения или исчезновения материи. Например, если 4 г водорода сгорают в кислороде с образованием 36 г воды, то следует заключить, что в этой реакции принимают участие 32 г кислорода.
Химическое уравнение: 2H2 (газ) + O2 (газ) ъ= 2H2O (газ) Соединяющиеся массы: 4 г + 32 г = 36 г
Закон постоянства состава, или постоянных отношений (Пруст, 1797 г.). Согласно этому закону, каждое чистое соединение всегда состоит из одних и тех же элементов, связанных между собой в одинаковом весовом отношении. На этом законе основано приведенное выше определение соединения.
Закон кратных отношений (Дальтон, 1803 г.). Этот закон гласит, что если какие-либо два элемента, А и В, могут связываться между собой, образуя несколько разных соединений, то весовые (массовые) количества элемента А, которые связываются с постоянным весовым количеством элемента В, пропорциональны небольшим целым числам. Например, поскольку Ar(H) = 1 и Ar(0) = 16, то весовое отношение Н:0 для воды (H2O) равно 2: 16, а весовое отношение Н:0 для перекиси (пероксида) водорода (H2O2) равно 2:32, или 1:16. Следовательно, весовое отношение водорода, связанного с постоянным весовым количеством кислорода (скажем, 16 г) в воде и в пероксиде водорода, равно 2:1.
Закон эквивалентных отношений (Рихтер, 1792 г.). Этот закон гласит, что весовые количества двух или нескольких веществ, которые порознь вступают в химические реакции с постоянным весовым количеством третьего вещества, совпадают с весовыми количествами двух первых веществ в их реакции друг с другом или являются простыми кратными этих количеств. Рассмотрим, например, две следующие реакции:
Химическое уравнение: 2H2 (газ) + O2 (газ) = 2H2O (газ) Соединяющиеся массы: 4 г + 32 г = 36 г
Химическое уравнение: С (тв.) + O2 (газ) = CO2 (газ) Соединяющиеся массы: 12г +32 г =44г
Располагая этими данными и пользуясь законом эквивалентных отношений, можно предсказать, что углерод и водород должны соединяться в весовом отношении 12:4. Таково в действительности весовое отношение углерода и водорода в метане (CH4).
закон эквивалентов – число эквивалентов участников процесса есть постоянная величина
4.Основные понятия химической термодинамики: термодинамическая система, параметры состояния и функции термодинамической системы. 1-ый закон термодинамики. Энтальпия. Экзо- и эндотермические реакции. Термодинамическая система — выделяемая (реально или мысленно) для изучения макроскопическая физическая система, состоящая из большого числа частиц и не требующая для своего описания привлечения микроскопических характеристик отдельных частиц[1], «часть Вселенной, которую мы выделяем для исследования»[2]. Единицей измерения числа частиц в термодинамической системе обычно служит число Авогадро[3]. Ограничения на природу материальных частиц, образующих термодинамическую систему, не накладываются: это могут быть атомы, молекулы, электроны, ионы, фотоны и т. д.[4], [5]. Любой объект, видимый невооружённым глазом или с помощью оптических приборов (микроскопы, телескопы и т. п.), можно отнести к термодинамическим системам: «Термодинамика занимается изучением макроскопических систем, пространственные размеры которых и время существованиядостаточны для проведения нормальных процессов измерения»[4].
Любую часть термодинамической системы называют подсистемой.
Для описания термодинамической системы используются макроскопические параметры, характеризующие не свойства составляющих её частиц, а свойства самой системы: температуру, давление, магнитную индукцию, электрическую поляризацию, массу и химический состав компонентов и др.[6], [7].
Каждая термодинамическая система имеет границы, реальные или условные, отделяющие её от окружающей среды[8]. Иногда вместо окружающей среды говорят о термостате[4].
Термодинамические системы служат предметом изучения термодинамики, статистической физики и физики сплошных сред.
ПАРАМЕТРЫ СОСТОЯНИЯ
(термодинамические параметры) - физ. величины, характеризующие равновесное состояние термодинамические системы: темп- pa, объём, плотность, давление, намагниченность, электрич. <поляризация и др. Различают экстенсивные П. с., пропорциональные объёму(или массе) системы ( внутренняя энергия U, энтропия S, энтальпия Н, свободная энергия F, Гиббса энергия G),и интенсивные П. с., не зависящие от массы системы (темп-pa Т, давление Р, концептрация с, хим. потенциал ).В состоянии термодинамич. равновесия П. с. не зависят от времени и пространств. <координат. В неравновесном (квазиравновесном) состоянии П. с. могут зависеть от координат и времени.
Термодииамич. состояние определяется заданием совокупности независимых П. с. Однако не все П. с. являются независимыми. Уравнение состояния выражает зависимые П. с. через независимые; напр., давлениеявляется ф-цией темп-ры и объёма Р = P(V, Т). Объём является внешнимП. с., т. к. определяется положением внеш. тел (стенки сосуда, положениепоршня). Темп-pa зависит только от внутр. состояниясистемы и наз. внутреннимП. с. В общем случае Р= Р(а1,..., а п, Т), где а i - внеш. П. с.
Элементарная работа термодинамич. системы определяется П. с., напр. для жидкости или газа =PdV, а в общем случае где Х i = Х i (а1,..., а п, Т) - обобщённые силы, являющиеся также П. с. Каждому набору независимыхП. с. соответствуют определ. потенциалы термодинамические (характеристические функции), определяющие все термодинамич. свойства системы и зависящие лишь от выбранных параметров; напр., внутр. энергия U = U(V, S), энтропия S = S(V, U), энтальпия H = Н(Р, S),энергия Гельмгольца(свободная энергия F = F(V, Т), энергия Гиббса G= G(P,T, N), N - число частиц. Для многокомпонентных систем нужно учитыватьещё дополнит. П. с.: концентрации компонент с i или иххим. потенциалы .Для многофазных систем каждая фаза описывается своим парциальным термодинамич. <потенциалом
Функция состояния в термодинамике — функция независимых параметров, определяющих равновесное состояние термодинамической системы; не зависит от пути (характера процесса), следуя которому система пришла в рассматриваемое равновесное состояние (т.е. не зависит от предыстории системы); к функциям состояния относят, в частности, характеристические функции системы: внутренняя энергия; энтропия; энтальпия и др.
Термодинамическая работа и количество теплоты не являются функциями состояния, так как их значение определяется видом процесса, в результате которого система изменила своё состояние
1-й закон термодинамики, внутренняя энергия, тепло, работа, энтальпия, энтропия.
Первый закон термодинамики гласит, (4 разные формулировки) что :
Энергия не может быть создана или уничтожена (закон сохранения энергии), она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы против внешних сил.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе и не зависит от способа, которым осуществляется этот переход.
Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Первый закон термодинами гласит, что энергия не может быть создана или уничтожена. Таким образом, энергия системы (замкнутой) - постоянна. Тем не менее, энергия может быть передана от одного элемента системы другому. Рассмотрим замкнутую систему, изолированную от остальных.
Передача энергии между различными подсистемами в ней может быть описана как :
E1 = E2
Где E1 = начальная энергия,E2 = конечная энергия
Внутрення энергия включает :
Кинетическую энергию движения атомов
Потенциальную энергию хранящуюся в химических связях
Гравитационную энергию системы
Первый закон является основой для термодинамической науки и инженерного анализа.
1й закон не дает информации о характере процесса и не определяет конечного состояния равновесия. Интуитивно мы понимаем, что энергия переходит от объекта с более высокой температурой к объекту с менее высокой температурой. Таким образом, 2й закон нам нужен для получения информации о характере процесса.
Энтальпия -
это "термодинамический потенциал " используемый в химической термодинамике реакций и не циклических процессов.
однозначная функция состояния термодинамической системы при независимых параметрах энтропии и давления, связана с внутренней энергией соотношением, приведенным ниже.
это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия определяется как:
H = U + PV
Где H = энтальпия,U = внутренняя энергия,P = давление,V = объем системы
При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе, поэтому энтальпию часто называют тепловой функцией или теплосодержанием. В состоянии термодинамического равновесия энтальпия системы минимальна.
Энтальпия является точно измеряемым параметром, когда определены способы выражения трех других поддающихся точному определению параметров формулы выше.
Энтропия.
Термин "энтропия" - величина, характеризующая степень неопределенности системы.
Однако, в термодинамике это понятие используется для определения связанной энергии системы. Энтропия определяет способность одной системы влиять на другую. Когда объекты пересекают нижнюю границу энергетического уровня необходимого для воздействия на окружающую среду, энтропия возрастает. Энтропия связана со вторым законом термодинамики.
Энтропия (обычно обозначается S), функция состояния термодинамической системы, изменение которой dS в равновесном процессе равно отношению количества теплоты dQ, сообщенного системе или отведенного от нее, к термодинамической температуре Т системы.
в символьном виде записывается, как
dS=(dQ)/T
где dS - изменение термодинамической системы, dQ - количество теплоты, сообщенное системе
T - термодинамическая температура системы
Неравновесные процессы в изолированной системе сопровождаются ростом энтропии, они приближают систему к состоянию равновесия, в котором S максимальна (закон неубывания энтропии).
Для вселенной в целом энтропия возрастает.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится с энергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей — энергия, выделенная при образовании связей продуктов реакции.
Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. При сгорании водорода, например:
2H2 + O2 → 2 H2O
изменение энтальпии равно ΔH = −483,6 кДж на один моль O2.
Эндотерми́ческие реа́кции (от др.-греч. ἔνδον — внутри и θέρμη — тепло) — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (ΔH>0, ΔU>0), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
реакции восстановления металлов из оксидов,
электролиза (поглощается электрическая энергия),
электролитической диссоциации (например, растворение солей в воде),
ионизации,
фотосинтеза.
Эндотермические реакции противоположны экзотермическим реакциям.
Вопрос 5
Законы термохимии. Закон Лавуазье-Лапласа. Закон Гесса. Следствие из закона Гесса.
Первый закон термохимии (Лавуазье и Лаплас, 1780—1784):
тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
Из закона Лавуазье—Лапласа следует невозможность построить вечный двигатель I рода, использующий энергию химических реакций.
Второй закон термохимии (Г. И. Гесс, 1840):
тепловой эффект химической реакции не зависит от характера и последовательности отдельных ее стадий и определяется только начальными и конечными продуктами реакции и их физическим состоянием (при p=const или при v=const).
Г. И. Гесс первый принял во внимание физическое состояние реагирующих веществ, так как теплоты изменения агрегатных состояний веществ накладываются на тепловой эффект реакции, увеличивая или уменьшая его.
Утверждение закона Гесса о том, что тепловой эффект процесса не зависит от его отдельных стадий и их последовательности, дает возможность рассчитывать тепловые эффекты реакций для случаев, когда их определить экспериментально или очень трудно, или вообще невозможно.
Закон Гесса в наши дни применяют главным образом для расчета термодинамических функций—энтальпий, которые сейчас используются для термохимических расчетов.
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций.
Следствие из закона Гесса – изменения энтальпии химической реакции равно разности суммы энтальпий продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
Третий закон термохимии (Кирхгоф).
Тепловой эффект химической реакции или изменение энтальпии в реакции зависят от температуры. Однако большинство термохимических данных в справочниках приведено при температуре 298 К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
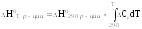
где Ср = а + bT + cT2 + cT2 , причем значения a, b, c и c, используемые для расчета теплоемкости участников реакции и изменения теплоемкости в ходе реакции, представлены в термодинамических справочниках для соответствующих веществ.
Уравнение объясняет температурную зависимость теплового эффекта изменением теплоёмкости веществ и является одним из аналитических выражений закона Кирхгофа:
Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса.
6.2-Й закон термодинамики. Энтропия. Направление протекания химической реакции.
ЗАКОН ТЕРМОДИНАМИКИ ВТОРОЙ
Фундаментальный закон, согласно которому процессы, связанные с превращениями энергии, могут происходить самопроизвольно только при условии, что энергия переходит из концентрированной формы в рассеянную (например, тепло горячего предмета самопроизвольно стремится рассеяться в более холодной среде). Другая его формулировка: поскольку некоторая часть энергии всегда рассеивается в виде недоступной для использования тепловой энергии, эффективность самопроизвольного превращения кинетической энергии (например, света) в потенциальную (например, энергию химических соединений протоплазмы) всегда меньше 100%. Важнейшая термодинамических характеристика организмов, экосистем и биосферы в целом — способность создавать и поддерживать высокую степень внутренней упорядоченности, т.е. состояние с низкой энтропией. Система обладает низкой энтропией, если в ней происходит непрерывное рассеяние легко используемой энергии (например, энергия света или пищи) и превращение ее в энергию, используемую с трудом (например, в тепловую). Упорядоченность экосистемы, т.е. сложная структура биомассы, поддерживается за счет дыхания всего сообщества, которое, по Ю. Одуму (1975), как бы откачивает из сообщества неупорядоченность”. Второму закону термодинамики подчиняется принцип экологических пирамид, а также из него вытекаетЗакон Линдемана.
ЭНТРОПИЯ
Несоответствие между превращением теплоты в работу и работы в теплоту приводит к односторонней направленности реальных процессов в природе, что и отражает физический смысл второго начала термодинамики в законе о существовании и возрастании в реальных процессах некой функции, названной энтропией , определяющей меру обесценения энергии.
Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии.
Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях обратимого течения процессов:
![]() .
.
Принцип возрастания энтропии сводится к утверждению, что энтропия изолированных систем неизменно возрастает при всяком изменении их состояния и остается постоянной лишь при обратимом течении процессов:
![]() .
.
Оба вывода о существовании и возрастании энтропии получаются на основе какого-либо постулата, отражающего необратимость реальных процессов в природе. Наиболее часто в доказательстве объединенного принципа существования и возрастания энтропии используют постулаты Р.Клаузиуса, В.Томпсона-Кельвина, М. Планка.
В действительности принципы существования и возрастания энтропии ничего общего не имеют. Физическое содержание: принцип существования энтропии характеризует термодинамические свойства систем, а принцип возрастания энтропии – наиболее вероятное течение реальных процессов. Математическое выражение принципа существования энтропии – равенство, а принципа возрастания – неравенство. Области применения: принцип существования энтропии и вытекающие из него следствия используют для изучения физических свойств веществ, а принцип возрастания энтропии – для суждения о наиболее вероятном течении физических явлений.
Направление протекания химического процесса определяется двумя факторами: изменением энтальпии и изменением энтропии. С одной стороны, любая система стремится к возрастанию энтропии, а, с другой - она же стремится к уменьшению энтальпии. Возможность протекания процесса зависит от того, какой вклад составляющих - энтальпийной и энтропийной - в энергию Гиббса окажется больше. [1]
