
- •Вопрос 5
- •6.2-Й закон термодинамики. Энтропия. Направление протекания химической реакции.
- •7.Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчет энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
- •10. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
- •15.Растворы электролитов. Катионы анионы.
- •16.Каков механизм диссоциации солей в растворах или расплавах
- •18.Слабые электролиты. Константа и степень диссоциации
- •19.Вода как слабый электролит.Индикаторы.
- •20.Сущность гидролиза солей.
- •21.Гидролиз солей.
- •22.Константа гидролиза
- •1.Природа соли
- •2. Концентрация соли
- •3. Температура
- •4. Присутствие одноименных ионов
- •23.Химическая связь в комплексных соединениях и их строение
- •24. Диссоциация комплексных соединений с комплексным анионом и комплексным катионом. Константа нестойкости комплексного иона. Номенклатура комплексных соединений. Двойные соли.
- •25. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчета степени окисления. Высшая низшая и средняя степень окисления.
- •26.Важнейшие окислители. Важнейшие восстановители.
- •27.Классификация окислительно-восстановительных реакция (привести примеры, составить уравнения реакции)
- •29.1.Стандартный электродный потенциал металла (е0)
- •2.Ряд напряжений
- •31.Сущность коррозийных поцессов.
29.1.Стандартный электродный потенциал металла (е0)
Потенциал, возникающий в электрохимической цепи, когда один из электродов опускают в одномолярный раствор соли металла, а вторым электродом является стандартный электрод.
2.Ряд напряжений
(реже — ряд активностей)
последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов (См. Электродный потенциал) в растворах электролитов. Наибольшие отрицательные потенциалы характерны для щелочных металлов (около — 3 в), за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют благородные металлы
3.Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
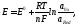
где
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
R — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T — абсолютная температура;
F — постоянная Фарадея, равная 96485,35 Кл·моль−1;
n — число молей электронов, участвующих в процессе;
aOx и aRed — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
30.Практическое применение электрохимических процессов в науке, технике, современном производстве. В основе науки о коррозии и технологий борьбы с коррозионными потерями
электрохимические методы защиты от коррозии различных видов аппаратуры
химические источники тока, разработки различных систем гальванических элементов, батареек, аккумуляторов, топливных элементов, электрохимических генераторов, а также технологии их изготовления. Отчистка металов.
-научно обоснованные электрохимические технологии широко применяются для решения экологических проблем, в частности, очистки сточных вод самых различных производств (химических, гальванических, лакокрасочных, нефтяных, биотехнологических), регенерации электролитов, извлечения металлов из промывных вод и отходов производства;
-электрохимический метод лежит в основе технологии обессоливания воды, значительная часть физико-химических методов исследований и анализов зиждется на электрохимических принципах;
-электрохимический синтез простых и сложных неорганических соединений хорошо известен и широко применяется в химической промышленности.
31.Сущность коррозийных поцессов.
Каждый метал стремится вернуться в привычное состояние. Коррозия металлов - процесс разрушения металлов вследствие химического, электрохимического или биохимического взаимодействии с окружающей средой.
Классификация .
Химическая коррозия– это разрушение металлов в окислительных средах при высоких температурах. Различают два вида: газовая (т. е. окисление металла при нагреве) и коррозия в неэлектролита.
Электрохимическая
атмосферная– характеризует процесс в условиях влажной воздушной среды.
подземная– разрушение металла в почвах и грунтах.
жидкостная коррозия, или коррозия в электролитах. Ее частным случаем является подводная коррозия– разрушение металлических конструкций, погруженных в воду.
Биохимическая коррозия - это процесс, связанный с воздействием микроорганизмов на металл. При этом металл может разрушаться как из-за того, что он служит питательной средой для микроорганизмов, так и под действием продуктов, образующихся в результате их жизнедеятельности. Биохимическая коррозия в чистом виде встречается редко, поскольку в присутствии влаги протекает одновременно и электрохимическая коррозия. Поэтому при рассмотрении отдельных видов коррозии разрушения, вызванные биохимической коррозией, относят к разрушениям от электрохимической коррозии.
