
Khimia_3
.pdf
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«БЕЛОРУССКО-РОССИЙСКИЙ УНИВЕРСИТЕТ»
Кафедра«Технологииметаллов»
ХИМИЯ
Методическиеуказаниякпрактическимзанятиям идлясамостоятельнойподготовкистудентоввсех специальностейдневнойизаочнойформобучения
СТРОЕНИЕАТОМАИХИМИЧЕСКАЯСВЯЗЬ
Могилев2011
2
УДК 54 ББК 24
Х 46
Рекомендовано к опубликованию учебно-методическим управлением
ГУ ВПО «Белорусско-Российский университет»
Одобрено кафедрой «Технологии металлов» «25» мая 2011 г., протокол № 10
Составители: канд. хим. наук, доц. И. М. Лужанская; канд. биол. наук, ст. преподаватель И. А. Лисовая
Рецензент канд. хим. наук И. В. Гарист
В методических указаниях рассмотрены основные понятия и законы химии, сопровождающиеся примерами, формулами, расчетами. Представлены примеры решения типовых задач. Приведены контрольные вопросы и задачи, отвечающие требованиям, предъявляемым к уровню освоения материала, изложенного в методических указаниях.
Учебное издание ХИМИЯ
Ответственный завыпуск |
Д. И. Якубович |
||
Технический редактор |
А. Т. Червинская |
||
Компьютерная верстка |
Н. П. Полевничая |
||
Подписано в печать |
. Формат 60×84/16. Бумага офсетная. Гарнитура Таймс. |
||
Печать трафаретная. Усл.-печ. л. |
. Уч.-изд. л. |
. Тираж 71 экз. Заказ № |
|
Издатель и полиграфическое исполнение Государственное учреждение высшего профессионального образования
«Белорусско-Российский университет» ЛИ № 02330/375 от 29.06.2004 г. 212000, г. Могилев, пр. Мира, 43
© ГУВПО«Белорусско-Российский университет», 2011
3
1 Строение атома
1.1 Современные представления о строении атома
Атом – химически неделимая частица химического элемента. Он представляет собой электронейтральную систему, состоящую из положительно заряженного ядра и отрицательно заряженных электронов.
Ядра атомов состоят, главным образом, из двух типов частиц (нуклонов) – протонов (р) и нейтронов (n). Заряд протона равен по величине и противоположен по знаку заряду электрона; масса его равна приблизительно одной а. е. м. Нейтрон – незаряженная частица с массой, приблизительно равной массе протона.
Линейные размеры атома – ~10-8 см, ядра – ~10-12–10-13 см. Основная масса атома сосредоточена в ядре и определяется массо-
вым числом А (относительная атомная масса), равным сумме числа протонов (заряда ядра) Z и числа нейтронов N: A = Z + N.
Главной характеристикой атома является заряд ядра (Z). Он определяет число электронов, находящихся вокруг ядра, т. е. принадлежность атома к данному виду химических элементов, и соответствует атомному номеру (в периодической системе элементов – порядковому номеру) элемента.
В обозначении атома элемента отражаются массовое число и количество протонов – AZЭ, например, кислород – 168O.
Большинство элементов в природе встречаются в виде атомов, характеризующихся разными атомными массами. Такие атомы называются изотопы.
Изотопы – разновидности атомов определенного химического элемента, имеющие одинаковый атомный номер, но разные массовые числа. Изотопы обладают ядрами с одинаковым числом протонов и различным числом нейтронов, имеют одинаковое строение электронных оболочек и занимают одно и то же место в периодической системе химических элементов.
Относительные атомные массы элементов, приводимые в периодической системе, – это средние массовые числа природных смесей изотопов, поэтому они и отличаются от целочисленных значений.
Например, химический элемент таллий (Tl) встречается в виде двух изотопов: таллий – 203 (20381Tl ) и таллий –205 (20581Tl) в количестве 29,5 и 70,5 % соответственно. Количество нейтронов в ядрах атомов изотопов таллия составляет соответственно 122 и 124.
Средняя атомная масса таллия Aср равна:
Aср = (0,295 · 203 + 0,705 · 205) / 2 = 204,383.
4
1.2 Строение электронной оболочки атома
1.2.1 Квантовые числа электрона. При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются их химические свойства.
Поведение и свойства электронов в атоме описываются с помощью квантовой механики, представляющей собой систему понятий и уравнений, характеризующих состояние микрочастиц.
С точки зрения квантовой механики, наиболее важной характеристикой системы является ее энергия. Состояние электрона в атоме было описано уравнением, предложенным одним из создателей квантовой механики, австрийским физиком Эрвином Шредингером.
Результаты, полученные при решении уравнения Шредингера, показывают, что полная энергия электрона в атоме квантована, то есть принимает не любые, а лишь вполне определенные дискретные значения.
Энергияэлектронаватомезависитоттреххарактеристикегодвижения:
1)расстояния от ядра, то есть от размера орбитали;
2)орбитального момента, возникающего при движении электрона вокруг ядра, то есть от формы орбитали;
3)магнитного момента, возникающего вследствие того, что электрон – заряженная частица, движущаяся по замкнутому контуру.
Поскольку полная энергия электрона в атоме квантуется, то, очевидно, квантуются и характеристики, от которых она зависит. Таким образом, наиболее вероятное расстояние от ядра, орбитальный и магнитный моменты электрона принимают лишь вполне определенные дискретные значения и между ними существует строгая количественная связь, выражаемая отношением целых чисел. Эти числа называются квантовыми и обозначаются соответственно: n –главное квантовое число; l – орбитальное
или побочное квантовое число; ml – магнитное квантовое число. Электроны характеризуются двойственной природой: они имеют
свойства и частицы, и волны. Для движущегося электрона невозможно указать его точное местоположение, можно лишь определить вероятность нахождения в различных частях внутриатомного пространства. Область пространства, в которой наиболее вероятно нахождение электрона, назы-
вается атомной орбиталью (АО).
Главное квантовое число n определяет энергию электрона в ато-
ме и размер АО, т. е. удаленность электрона от ядра. Главное квантовое число n принимает значения целых чисел 1, 2, 3, 4, … Совокупность электронов с одинаковым значением n называется энергетическим уровнем. Наименьшую энергию имеют электроны первого от ядра энергетического уровня (n = 1); с увеличением n энергия электрона и его удаленность от
5
ядра возрастают. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным, или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными. Энергетические уровни обозначают буквами:
числовое значение n |
1 |
2 |
3 |
4 |
5 |
6 |
7 ; |
буквенное обозначение |
K |
L |
M |
N |
O |
P |
Q . |
По положению химического элемента в периодической системе можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Например, элемент кадмий Cd расположен в пятом периоде, значит в его атоме электроны раcпределены по пяти энергетическим уровням
(n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
На одном и том же энергетическом уровне могут находиться атомные орбитали различной формы, отличающиеся друг от друга по энергии. Энер-
гию электрона на подуровне и форму атомной орбитали характеризует
орбитальное квантовое число l. Значение l зависит от главного квантового числа: l принимает значения от 0 до (n – 1), т. е. 0, 1, 2, 3, … (n – 1).
В пределах данного энергетического уровня совокупность электронов, характеризующихся одинаковым значением l, называется энергетическим подуровнем. Подуровни обозначают буквами:
орбитальное квантовое число l |
0 |
1 |
2 |
3 ; |
обозначение энергетического подуровня |
s |
p |
d |
f . |
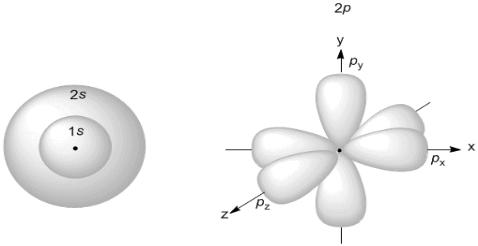
На рисунке 1 изображены формы и пространственная ориентация атомных орбиталей.
Рисунок 1 – Форма и пространственная ориентация s-, p-орбиталей
6
При данном значении главного квантового числа n наименьшую энергию имеют электроны s-подуровня, затем – p-, d-, f-подуровней. Электроны различных подуровней называют s-, p-, d-, f-электронами. В этом случае говорят также о состояниях s-, p-, d-, f-электронов, или s-, p-, d-, f-атомных орбиталях.
Число энергетических подуровней в уровне не должно быть больше главного квантового числа n. Так, первый уровень (n = 1) имеет один подуровень (s), второй уровень (n = 2) – два подуровня (s и p), третий (n = 3) –
три (s, p, d), четвертый (n = 4) – четыре (s, p, d, f).
На первом энергетическом уровне (n = 1) орбитальное квантовое число l принимает единственное значение l = (n – 1) = 0. Форма орбитали – сферическая; на первом энергетическом только один подуровень – 1s.
Для второго энергетического уровня (n = 2) орбитальное квантовое число может принимать два значения: l = 0, s-орбиталь – сфера большего размера, чем на первом энергетическом уровне; l = 1, p-орбиталь – гантель. Таким образом, на втором энергетическом уровне имеются два подуровня –
2s и 2p.
Для третьего энергетического уровня (n = 3) орбитальное квантовое число l принимает три значения: l = 0, s-орбиталь – сфера большего размера, чем на втором энергетическом уровне; l = 1, p-орбиталь – гантель большего размера, чем на втором энергетическом уровне; l = 2, d-орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня – 3s, 3p и 3d.
На четвертом и последующих энергетических уровнях (n ≥ 4) могут быть четыре подуровня – 4s, 4p, 4d и 4f.
Каждый подуровень составлен из орбиталей, количество которых определяется магнитным квантовым числом (ml). Магнитное квантовое число ml определяет возможные ориентации орбитали в пространстве,
связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l, включая ноль. Определенному значению l соответствует (2l + 1) возможных значений магнитного квантового числа. Число значений ml указывает на число атомных орбиталей в подуровне и число возможных направлений, по которым они могут ориентироваться в пространстве.
Для s-подуровня l = 0 и потому ml имеет единственное значение: ml = 0. Таким образом, на s-подуровне имеется единственная s-орбиталь, которая расположена симметрично ядру атома.
Для p-подуровня l = 1 ml приобретает три значения: –1, 0, 1, т. е. р-подуровень имеет три р-орбитали и они ориентированы по трем осям координат.
Для d-подуровня (l = 2) ml приобретает пять значений: –2, –1, 0, 1, 2 и, следовательно, d-подуровень имеет пять d-орбиталей, которые ориен-
7
тированы по пяти разным направлениям.
Для f-подуровня (l = 3) ml приобретает семь значений: –3, –2, –1, 0, 1, 2, 3, т. е. f-подуровень имеет семь f-орбиталей. Число ориентаций f- орбиталей равно семи.
Таким образом, электроны в атоме располагаются по энергетическим уровням, удаленность которых от ядра характеризуется значением главного квантового числа n; уровни состоят из подуровней, число которых для каждого уровня не превышает значение n; в свою очередь, подуровень состоит из орбиталей, форма которых определяется значением орбитального квантового числа l, а количество задается числом значений магнитного квантового числа ml. Квантовые числа n, l, ml характеризуют орбиталь.
Кроме движения вокруг ядра, электрон вращается вокруг собственной оси. Это движение получило название «спин». Спиновое квантовое число ms характеризует два возможных направления вращения элек-
трона вокруг собственной оси (по часовой стрелке или против). Спиновое квантовое число ms принимает два значения: +1/2 и –1/2. Так как спинвеличина векторная, то его условно обозначают стрелкой, направленной вверх: ↑ или вниз: ↓. Электроны с одинаковым направлением спина называются параллельными, при противоположных значениях – антипараллельными. Два электрона с одинаковыми значениями n, 1, ml, но с противоположно направленными спинами ↓↑ называются спаренными, а с параллельными - неспаренными.
Четыре квантовых числа n, l, ml, ms полностью характеризуют состояние электрона в атоме.
1.2.2 Электронная конфигурация атома. Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией.
При записи электронной конфигурации номер уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4, …, подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов в подуровне обозначается цифрой, которая записывается вверху у символа подуровня. Например, элек-
тронная конфигурация атома серы имеет вид 16S 1s22s22p63s23p4, а ванадия
23V 1s22s22p6 3s23p63d34s2.
Порядок распределения электронов по энергетическим уровням подчиняется ряду принципов.
Согласно принципу Паули, в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Принцип Паули определяет максимальное число электронов на одной орбитали, уровне и подуровне. Так как АО характеризуется тремя квантовыми числами n, l, ml, электроны данной орбитали могут различать-
ся только спиновым квантовым числом ms. Но ms может иметь только два значения +1/2 и –1/2.
8
Следовательно, на одной орбитали может находиться не более двух электронов с противоположно направленными спинами. Максимальное число электронов на энергетическом уровне определяется как 2n2, а на подуровне – как 2(2l + 1).
Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом минимальной энергии, согласно ко-
торому электроны заполняют орбитали в порядке повышения уровня
энергии орбиталей.
Очередность орбиталей по энергии определяется правилом Клечковского: увеличение энергии и, соответственно, заполнение орбиталей происходит в порядке возрастания суммы (n + l), а при равной сумме (n + l) – в порядке возрастания n.
Правила Клечковского обуславливают следующую последовательность заполнения электронами энергетических уровней в атоме:
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈
≈5d ≈ 4f < 6p < 7s ≈ 5f ≈ 6d <7 p.
После подуровня 3p в указанной выше последовательности происходит заполнение не подуровня 3d, а подуровня 4s. Действительно, для подуровня 3d n + l = 3 + 2 = 5, а для 4s n + l = 4 + 0 = 4, что отвечает первому правилу Клечковского. Для подуровней 6s, 5d, 4f сумма n + l соответственно равна 6 + 0 = 6, 5 + 2= 7, 4 + 3= 7. Для этой последовательности соблюдаются оба правила Клечковского.
Порядок размещения электронов в пределах одного подуровня опре-
деляется правилом Хунда: в пределах подуровня электроны размещаются так, чтобы их суммарный спин был максимальным. Иными сло-
вами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем – по второму электрону с противоположными спинами.
Наглядно правила заполнения электронных орбиталей в атомах де-
монстрирует орбитальная или энергетическая диаграмма. В этом слу-
чае орбиталь изображается в виде квадратика, а электроны – в виде стрелок.
На рисунке 2 изображены энергетические диаграммы атомов серы
(S) и ванадия (V).
16S |
23V |
Рисунок 2 – Энергетические диаграммы атомов серы и ванадия

9
Суммарный спин р-электронов третьего энергетического уровня атома
серы Σms = ½ – ½ + ½ + ½ = 1; d-электронов атома ванадия – Σms = ½ + ½ + + ½ = 3/2.
Часто графически изображают не всю электронную формулу, а лишь те подуровни, на которых находятся валентные электроны. На рисунке 3 приведена запись электронной конфигурации атомов серы и ванадия с графическим изображением валентных электронов.
16S…3s2 3p4 |
; |
23V…3d34s2 |
Рисунок 3 – Энергетические диаграммы валентных электронов серы и ванадия
1.3 Электронные семейства элементов
В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на четыре электрон-
ных семейства: s-, p-, d-, f-элементы.
Уs-элементов в последнюю очередь заполняется s-подуровень внешнего уровня. У них валентными являются s-электроны внешнего энергетического уровня. К s-элементам относятся элементы, расположенные в главных подгруппах I–II групп периодической системы, а также водород и гелий.
Ур-элементов последним заполняется р-подуровень внешнего уровня.
Уних валентные электроны расположены на p- и s-подуровнях внешнего уровня. К p-элементам относятся элементы главных подгрупп III–VIII групп, кроме водорода и гелия.
Уd-элементов в последнюю очередь заполняется d-подуровень предпоследнего уровня и валентными являются s-электроны внешнего и d-электроны предпоследнего энергетического уровней. К d-элементам относятся элементы побочных подгрупп I–VIII групп.
Уf-элементов последним заполняется f-подуровень третьего снаружи энергетического уровня. К f-элементам относятся актиноиды и лантаноиды.
1.4 Атомная валентная зона. Возможные валентные состояния
Атомная валентная зона (АВЗ) – часть электронной оболочки, на которой расположены валентные электроны.
Валентность – способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. Согласно спин-валентной теории в образовании связи могут участвовать
10
только свободные электроны.
Если все электроны в атоме занимают орбитали в соответствии с законом минимума энергии, то и атом обладает минимальным запасом энергии. Такое состояние называется нормальным или основным.
Например, у атома кальция в основном состоянии на внешнем энергетическом уровне находятся два спаренных электрона. Электронная кон-
фигурация кальция имеет вид 20Ca 1s22s22p63s23p64s2.
Следовательно, в основном состоянии валентность кальция равна
нулю.
Поглощая энергию извне, электроны переходят на орбитали с более высоким запасом энергии, которые в нормальном состоянии не заняты. Такое состояние атома называется возбужденным. Существуют различные способы возбуждения: тепловое возбуждение, фотовозбуждение, возбуждение с помощью электрического разряда, возбуждение в ходе химической реакции.
Валентные электроны слабее других связаны с ядром, поэтому они легче переходят в возбужденное состояние. При этом происходит переход с энергетического подуровня с меньшей энергией на энергетический подуровень с большей энергией в пределах одного уровня, что приводит к
расширению АВЗ.
В результате расширения валентной зоны атома кальция s – электроны внешнего энергетического уровня распариваются, один из них
переходит на p– подуровень: 20Ca 1s22s22p63s23p64s14p1. Валентность кальция в возбужденном состоянии равна двум.
При графическом изображении электронной конфигурации атома в возбужденном состоянии наряду с заполненными изображают вакантные валентные орбитали. Например, в атоме фосфора на третьем энергетическом уровне имеются одна s-АО, три р-АО и пять d-АО. На рисунке 4 изображена электронная конфигурация атома фосфора в основном состоянии.
15Р… 3s2 3p3 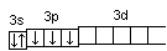 .
.
Рисунок 4 – Электронная конфигурация атома фосфора в основном состоянии
Валентность фосфора, определяемая числом неспаренных электронов, равна 3. При переходе атома в возбужденное состояние происходит распаривание электронов состояния 3s и один из электронов с s-подуровня может перейти на d-подуровень. На рисунке 5 показана электронная конфигурация атома фосфора в возбужденном состоянии.
