
Khimia_3
.pdf
11
Р*… 3s2 3p3 3d1 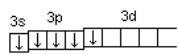
Рисунок 5 – Электронная конфигурация атома фосфора в возбужденном состоянии
При этом валентность фосфора меняется с трех (РСl3) – в основном состоянии до пяти (РCl5) – в возбужденном.
На рисунке 6 показано расширение атомной валентной зоны атома никеля (28Ni 1s22s22p63s23p63d84s2).
Рисунок 6 – Расширение атомной валентной зоны атома никеля
Валентность никеля в основном состоянии равна нулю, т. к. неспаренные электроны на d-подуровне экранированы электронной парой на s-подуровне. При определении валентности атома никеля в возбужденном состоянии следует учитывать, что хотя у никеля присутствуют и спаренные электроны на 3d-подуровне, и вакантные места на 4р-подуровне, мы не можем переместить эти электроны с 3d-подуровня на 4р-подуровень, поскольку это различные энергетические уровни. В возбуждённом состоянии валентность никеля составляет значение от 2 до 5.
1.5 Проскок (провал) электронов
Проскок электрона – отступления от общей для большинства элементов последовательности заполнения электронных оболочек, связанные с тем, что эти «нарушения правил» обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек «по правилам».
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3; р6; d5; d10; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d-подуровня за счёт проскока (или провала) электрона с внешнего s-подуровня на нижележащий (предвнешний) d-подуровень.
Для ряда элементов закономерные проскоки приведены в таблице 1.
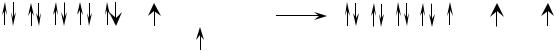
12
Таблица 1 – Проскоки электронов
Элемент |
Атомная валентная зона |
|
|
|
|
|
теоретическая |
практическая |
|
|
|
Cu |
3d9 4s2 |
3d10 4s1 |
Ag |
4d9 5s2 |
4d10 5s1 |
Au |
5d9 6s2 |
5d10 6s1 |
Cr |
3d4 4s2 |
3d5 4s1 |
Mo |
4d45s2 |
4d5 5s1 |
Согласно приведенным электронным конфигурациям медь одновалентна, так как в атоме только один неспаренный электрон.
На практике оказывается, что Cu проявляет валентность, равную двум. Следовательно, возможен, вопреки правилу, переход одного проскочившего электрона с предпоследнего 3d-подуровня на внешний 4р-подуро- вень. На рисунке 7 показано расширение атомной валентной зоны атома меди.
|
3d |
|
4s |
|
|
4p |
|
|
3d |
|
4s |
|
4p |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 7 – Расширение атомной валентной зоны атома меди
В этом случае максимальная валентность меди будет равна трем. На практике медь проявляет валетность (В), равную единице и двум.
Для золота характерна валентность В = 1; 2; 3. Расширение валентной зоны происходит таким же образом, как у меди. На практике золото чаще имеет валентность, равную трем, поскольку оно стоит в шестом периоде и электроны ядром удерживаются слабее.
Серебро же, хотя и имеет сходную структуру АВЗ, чаще проявляет валентность, равную единице.
Хром и молибдена имеют одинаковое строение АВЗ и проявляют одинаковую валентность от двух до шести.
13
2 Периодическая система элментов
Всовременной формулировке периодический закон звучит так:
свойства химических элементов, а также свойства и форма образуемых ими соединений находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов.
Периодическая система состоит из периодов и групп.
Периодом называется последовательный ряд элементов, располо-
женных в порядке возрастания заряда ядра их атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода).
Все периоды начинаются с s-элемента и заканчиваются p-элементом (у первого периода s-элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным.
По вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства. Атомы эле-
ментов одной и той же группы имеют одинаковое число валентных электронов.
Количество валентных электронов в оболочке атома, как правило, равно номеру группы, в которой находится элемент.
Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги).
Вглавных подгруппах расположены s-элементы (I, II групп) и p-элементы (III–VIII групп). В атомах элементов главных подгрупп валентные электроны находятся на s- и р-подуровнях внешнего энергетического уровня и общее их число равно номеру группы.
Впобочных подгруппах располагаются d- и f-элементы. Валентные электроны в атомах d-элементов находятся на s-подуровне внешнего и d-подуровне предпоследнего энергетических уровней.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
2.1 Периодичность атомных характеристик
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус, энергия ионизации, электроотрицательность.
2.1.1 Атомный радиус. Атомы не имеют строго определенных границ из-за корпускулярно-волнового характера электронов. Поэтому абсолютное значение радиуса атома определить невозможно. Можно условно принять за радиус атома теоретически рассчитанное значение расстояния
14
от ядра до наиболее удаленного от него максимума электронной плотности или половину расстояния между центрами двух атомов в кристаллах.
Атомные радиусы в периодах с ростом порядкового номера элемента уменьшаются, т. к. при одинаковом числе электронных слоев возрастает заряд ядра, которыйсжимает электронные оболочки.
В пределах каждой подгруппы элементов радиусы атомов увеличиваются сверху вниз, так как возрастаетчислоэнергетическихуровней.
2.1.2 Энергия ионизации. Одним из важнейших свойств химического элемента, непосредственно связанным с электронной структурой атома, является ионизационный потенциал. Ионизационным потенциалом ЕИ называется та наименьшая энергия, которую необходимо затратить, чтобы отде-
лить электрон от атома и удалить его на бесконечно большое расстояние:
Э – e → Э+ − Еи .
Величину ионизационного потенциала принято выражать в элек- трон-вольтах на атом (эВ/атом) или килоджоулях (кДж/моль) на моль. Атомы элементов – восстановителей, теряя электроны, превращаются в положительно заряженные ионы. Для данного атома или молекулы энергия, необходимая для удаления первого электрона, называется первым ионизационным потенциалом E1, второго – вторым ионизационнымпотенциаломЕ2 и такдалее.
Атомы с небольшим потенциалом ионизации проявляют восстановительные свойства. Атомы с высоким потенциалом ионизации находятся в нейтральном состоянии. Потенциал ионизации возрастает по периоду. В пределах главных подгрупп потенциал ионизации убывает с увеличением порядкового номера элементов. Это обусловлено увеличением размеров атомов и расстояниемвнешних электронов отядра.
2.1.3Энергия сродства к электрону. Сродством к электрону называет-
ся энергия Еср , которая выделяется при присоединении электрона к атому, молекуле или радикалу: Э + e → Э− + Еср.
Сродство к электрону выражается в тех же единицах, что и ионизационныйпотенциал.
Атомы элементов-окислителей, принимая электроны, превращаются в отрицательно заряженные ионы. Энергия сродства к электрону изменяется
всоответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства
элементов возрастают. Наибольшие значения имеют галогены, кислород, сера, наименьшие – элементы с электронной конфигурацией s2 (Не, Ве, Мg, Zn) или наполовину заполненными р-подоболочками(Ne, Аг, Кг, N, Р, Аs).
2.1.4Электроотрицательность. Для характеристики способности атомов в соединениях притягивать к себе электроны введено понятие электроотрицательности (ЭО). Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элемента, данная характеристика имеетусловныйхарактер.
15
Имеется несколько шкал электроотрицательности. Согласно Р. Малликену, она равна полусумме энергии ионизации и энергии сродства к электрону:
ЭО = (Еи + Еср) / 2.
Учитывая сложность определения величины сродства к электрону, американский ученый Л. Полинг предложил вместо абсолютных значений электроотрицательности использовать относительные значения. Он принял электроотрицательность фтора равной 4. Тогда электроотрицательность лития, по отношению к которой были определены электроотрицательности других элементов, получиласьравной1.
Электроотрицательность возрастает слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и тойжегруппыпериодическойсистемыД.И. Менделеева.
2.1.5 Металлические свойства рассматриваются как способность атомов элементов легко отдавать электроны, а неметаллические – присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s-подуровня указывает на металлические свойства атома, а формирование внешнего p-подуровня – на неметаллические. Увеличение числа электронов на p-подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
Вбольших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т. к. происхо-
дит формирование внутреннего (n – 1) d-подуровня при сохранении внешнего ns2-слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2-электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np-подуровень, что объясняет значительное ослабление металлических свойств.
Вглавных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают.
2.1.6 Окислительно-восстановительные свойства нейтральных ато-
мов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, его принимающий.
Впериоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает.
Вподгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается.
Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями
визменении сродства к электрону.
16
2.1.7 Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным (таблица 2).
Таблица 2 – Изменение окислительно-восстановительных свойств соединений элементов третьего периода
Катион |
Na+ |
Mg2+ |
Al3+ |
Si4+ |
P5+ |
S6+ |
Cl7+ |
элемента |
|
|
|
|
|
|
|
Высший |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
оксид |
|
|
|
|
|
|
|
Гидроксид |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO7 |
высшего |
|
|
|
|
|
|
|
оксида |
|
|
|
|
|
|
|
Кислотно- |
Основные |
Амфо- |
Слабо- |
Средне- |
Сильно- |
||
основные |
|
|
терный |
кислот- |
кислот- |
кислотные |
|
свойства |
|
|
|
ный |
ный |
|
|
Сверху вниз в подгруппе при равенстве заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются: H3BO3 – слабая кислота, Al(OH)3, Ga(OH)3, In(OH)3 – амфотерные гидроксиды, Tl(OH)3
проявляет более выраженные основные свойства.
Аналогичная зависимость характерна для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду H2SO4, H2SeO4,
H2TeO4.
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I–III групп образуют твердые вещества – гидриды (водород в степени окисления – 1), а IV–VII групп – газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) – нейтральны, V группы (ЭН3) – основания, VI и VII групп (Н2Э и НЭ) – кислоты.
d-элементы побочных подгрупп склонны проявлять переменную степень окисления. Характер образуемых ими соединений зависит от степени окисления элемента. Соединения, в которых элемент находится в низшей степени окисления, имеют основной характер, в высшей степени – кислотный, в промежуточной – амфотерный. Например, хром проявляет степени
окисления +2, +3, +6 и характер образуемых им оксидов следующий: Cr+2O – основной, Cr+32O3 – амфотерный, Cr+6O3 – кислотный.
17
3 Химическая связь
Химической связью называют различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллов и других веществ. При образовании химической связи происходит: снижение общей энергии двух- и многоатомной системы по сравнению с суммой энергий изолированных частиц, из которых эта система состоит; перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние длины связи.
Энергией химической связи Есв называют количество энергии, выделяющееся при образовании связи.
Чем больше энергия связи, тем устойчивее молекула, тем прочнее
связь.
Важной характеристикой связи является длина связи 1св, равная расстоянию между ядрами атомов в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Связь обозначается черточкой, например: Н – J, О = О, Н – С = С – Н.
Правило октета. В результате образования химической связи атомы стремятся приобрести такую же электронную конфигурацию, как у благо-
родных газов ns2nр6, то есть восемь электронов на внешней оболочке. На-
пример, N 1s22р3 + 3 Н1s1 = NH3.
3.1 Основныевидыхимическойсвязи
3.1.1 Ковалентной связью называется химическая связь, образованная путем обобществления пары электронов двумя атомами. При этом снижается энергия системы.
Особенностями ковалентной химической связи являются ее направ-
ленность и насыщенность.
Направленность ковалентной связи объясняется тем, что атомные орбитали пространственно ориентированы и перекрывание электронных облаков происходит по определенным направлениям. Количественно она выражается в виде валентных углов между направлениями химической связи в молекуле.
Насыщаемость связана с ограничением числа электронов, находящихся на внешних оболочках, и определяет стехиометрию молекулярных химических соединений, от которой зависят формульный состав, массовые соотношенияэлементов, расчетыпоформуламиуравнениямит. д.
Полярность ковалентной связи. Связь, образованная одинаковыми атомами, называется гомеополярной, или неполярной, так как обобществленные электроны равномерно распределены междуатомами, например, вмолеку-
лахН2, О2, N2, S8.
18
Еслижеодиниз атомов сильнее притягивает электроны, то электронная пара смещается к нему и возникающая связь называется ковалентной
полярной.
Чем выше электроотрицательность (ЭО) атома, тем более вероятно смещение электронной пары в сторону ядра данного атома, поэтому разность ЭО ( ЭО) атомов характеризует полярность связи. Атом, к которому смещается электронная плотность, приобретает эффективный заряд δ–, второй атом имеет эффективный заряд δ+. Вследствие этого возникает диполь, имеющий два одинаковых по величине заряда δ+ и δ- и длину 1Д. Мерой полярности связи служит электрический момент диполя μсв = δ·1Д, Кл·м, где δ – эффективный заряд, 1Д – длина диполя. В качестве внесистемной единицы для измеренияμиспользуют Дебай D, 1 D = 3,3·10-30 Кл·м.
Порядок связи (кратность связи) – это число обобществленных поделенных пар между двумя связанными атомами. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
Например, порядок связи в молекулах H2, O2 и N2 равен 1, 2 и 3 соответственно, поскольку связь в этих случаях образуется за счёт перекрывания одной, двух и трех пар электронных облаков.
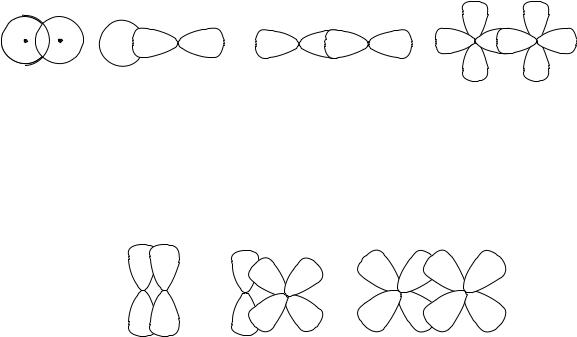
В образовании ковалентной связи могут принимать участие АО как одинаковой, так и различной симметрии. При перекрывании АО вдоль линии соединения атомов образуется σ-связь. Схема образования σ-связи приведена на рисунке 8.
s– s |
s–p |
p–p |
d–d |
Рисунок 8 – Схема образования σ-связи
При перекрывании АО по обе стороны от линии соединения атомов образуется π-связь. Схема образования π-связи приведена на рисунке 9.
p p |
p d |
d d |
Рисунок 9 – Схема образования π-связи
19
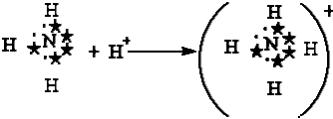
3.1.2 Донорно-акцепторная связь. Донорно-акцепторная связь, а точнее, донорно-акцепторный механизм образования ковалентной связи, реализуется за счет обобществления пары электронов, принадлежащих одному атому (донору) и вакантной орбитали другого атома (акцептору).
Например, у атома азота имеется три неспаренных электрона, которые образуют три ковалентные связи с тремя атомами водорода, по обменному механизму; но он может образовать еще одну связь за счет неподеленной пары электронов по донорно-акцепторному механизму с образованием иона аммония:
.
3.1.3 Ионная связь. Ионная связь – крайний случай ковалентной связи. Такая связь возникает между атомами, ЭО которых больше 2, например, между s-элементами I группы и р-элементами VI и VII групп (LiF, К2О, СsС1). Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов. Так как электрическое поле иона имеет сферический характер, то для ионной связи не характерны направленность и насыщаемость. Ионная химическая связь проявляется в твердых веществах с ионной кристаллической решеткой. Так как энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой ЭО. Поэтому и чисто ионные связи не существуют. Можно лишь говорить о той или инойдолиионностисвязи.
Таким образом, при образовании полярных ковалентных и ионных связей на атомах возникают электрические заряды. Величины зарядов не имеют целочисленных значений. В практических целях их удобно представлять в виде целых чисел, равных таким зарядам, которые возникли бы на атомах, если бы валентные электроны полностью переходили к более электроотрицательным атомам, т. е. если бы связи были полностью ионными.
Такие величины зарядов получили название степеней окисления. Степень окисления любого элемента в простом веществе всегда равна 0. В молекулах сложных веществ некоторые элементы всегда имеют постоянную степень окисления. Для большинства элементов характерны переменные степени окисления, различающиеся как знаком, так и величиной, в зависимости от состава молекулы.
Определение степени окисления элемента в какой-либо молекуле сводится к простой арифметической операции, так как сумма степеней окисле-
20
ния атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в
фосфорной кислоте Н3РО4. Поскольку у кислорода СО – –2, а у водорода – +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5:
[3· (+ 1) + 1· (+ 5) + 4· (–2) = 0].
3.1.4 Металлическая связь. Металлическая связь – связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
3.1.5 Метод валентных связей (ВС). Структура и свойства молекул с ковалентной связью могут быть объяснены с позиций метода валентных связей (ВС)
Основные положения метода ВС:
–по методу ВС химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар;
–образованная электронная пара локализована между двумя атомами. Такая связь является двухцентровой и двухэлектронной;
–химическая связь образуется только при взаимодействии электронов с антипараллельными спинами;
–характеристики химической связи (энергия, длина, полярность, валентные углы) определяются типом перекрывания АО;
–ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
На рисунке 10 приведена схема образования связи в молекуле фтора F2 по методу ВС.
