
Osnovy_vzaimodejstviya_ultrazvuka_s_biologicheskimi_obektami
.pdf
Из анализа приведенного выражения следует, что при l » l  значение
значение 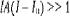 , и средняя скорость разрушения клеток в суспензии - линейная функция интенсивности ультразвука
, и средняя скорость разрушения клеток в суспензии - линейная функция интенсивности ультразвука  а при интенсивности ультразвука, близких к по роговым,
а при интенсивности ультразвука, близких к по роговым,
Из общих соображений следовало бы, что измерять различия в скорости разрушения клеток разных типов удо бнее при 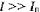 , где V линейно зависит от интенсивности ультразвука. Однако наи более существенные различия в параметрах, характеризующих процесс разрушения клеток крови здоровых и больных людей и животных, были об- наружены при интенсивностях ультразвука, близких к пороговым. Эти различия уменьшаются с увеличением интенсивности ультразвука и становятся пренебрежимо малыми при 0,6...0,8 .Вт/ см2.
, где V линейно зависит от интенсивности ультразвука. Однако наи более существенные различия в параметрах, характеризующих процесс разрушения клеток крови здоровых и больных людей и животных, были об- наружены при интенсивностях ультразвука, близких к пороговым. Эти различия уменьшаются с увеличением интенсивности ультразвука и становятся пренебрежимо малыми при 0,6...0,8 .Вт/ см2.
Рис. 2.11. Зависимость отношения скоростей разрушения лейкоцитов здоровых (V м) и больных лейкозом (V„) коров от интенсивности ультразвука
В качестве примера можн о привести зависимость отношения скоростей разрушения лейкоцитов здоровых и больных лейкозом коров от интенсивности ультразвука (рис. 2.11), Аналогичные зависимости получены и для клеток других тип ов.
Следует отметить, что даже в идеальных условиях поле в ближней зоне излучателя существенно неоднородно; наряду с максимумом здесь имеются области, где амплитуды звукового давления обра щается в пуль. Максимальные значения ам плитуды звукового давления могут быть в 3- 4 раза больше или меньше усредненных з начений, что следует учитывать при определении порогов физико-химического и биологического действия ультразвука.
Ультразвуковой метод, позволяющий оцепить механическую резистентность цитоплазматических мембран как усредненную для всей исследуем ой совокупности клеток, гак и с учетом индивидуальных различий их отдельных поп уляций, в последнее время все шире применя ют в экспериментальной биологии, медици не и ветеринарии. Ис- пользованный сначала для исследования эритроцитов этот метод был назван методом ультразвуковых эритрограмм. В дальнейшем ультразвуковой метод , пригодный для опенки механической резистентности не только эритроцитов, но и любых клеток в суспензии, стали называть методом ультразвуковых цитолизограм м.
По сути метод ультразвук овых цитолизограмм представляет собой метод определения кинетических параметров ультразвуковой дезинтеграции клеток, находящихся в

суспендированном состо янии. Необходимым условием для ультразвуковой дезинтеграции клеток с воспроизводимой кинетикой является стабильная кавитация. Очевидно, что разрушение клеток под действием ультразвука имеет вероятностны й характер.
Регистрируя любым способом изменение концентрации клеток в су спензии в процессе воздействия ультразвуко м, можно получить кривую, характеризующую распределение клеток по стойкости к ультразвуковому (механическому) воздейств ию - ультразвуковую цитолизограмму.
Наиболее удобный способ регистрации снижения концентрации клеток в суспензии - турбидиметрия, основанн ая на рассеянии света частицами среды, усредненный радиус которых более чем на пор ядок превышает длину волны рассеиваемого света. При этом длину волны обычно выбирают такой, чтобы поглощение света средой было мини- мальным.
Динамику турбидиметрического ослабления чаще всего регистрир уют фотоэлектрическим способом с помощью установки, которая состоит из двулучевого к олориметра, регистрирующего устройства, и генератора ультразвуковых колебаний с преобразователем небольших размеров,
В установке удобно использовать медицинские терапевтические ультразвуковые генераторы, обеспечивающие ультразвуковое излучение с частотой 880 кГц и интенсивностью в интервале 0,05...1 Вт/см2.
Принцип метода ультразв уковых цитолизограмм заключается в следующем.
При введении ультразвука в кювету колориметра с суспензией кле ток (рис. 2.12) последние начинают разрушаться, и светорассеяние изменяется, отражая уменьшение числа целых клеток. В кю вете с плоским стеклянным дном, параллельным излучающей поверхности преобразователя, возникает стоячая волна, и в этом случае ультразвуковое ноле может быть охарактеризовано средней плотностью энергии.
Рис. 2.12, Принцип метода ультразвуковых цитолизограмм:
1 - излучатель ультразвука; 2 - фотоэлектрический колориметр; 3 - кювета с суспензией клеток; 4 - регистратор

На диаграммной ленте непрерывно регистрируется сигнал, пропорциональный (для достаточно малых концен траций клеток) мгновенным значениям т урбидиметрического ослабления (рис. 2.13, а).
При турбидиметрических измерениях необходимо учитывать, что кавитации сопровождается увеличен ием мутности среды. Рассеяние снега одиночной частицей, в том числе кавитационным пузырьком, возрастает пропорционально квадрату радиуса пузырька, и, следовательно, для цитолизиса удобно использовать высокочастотный ультразвук, так как размеры резонансных кавитационных пузырько в в первом приближении обратно пропорциональны частоте. Однако при частотах ультразвука более 1,5 МГц клетки, находящиеся в суспензии, быстро оседают на дно кюветы, не успевая разрушиться. Поэтому для метода ультразвуковых цитолизограмм чаще всего используют ультразвук с частотой 1 МГц.
Рис. 2.13. Экспериментальная кривая (а) и нормированная кривая ( б) кинетики ультразвукового цитолизиса эритроцитов свиньи
При этой частоте порог кавитации в суспензии клеток около 0,35 Вт/см2, а резонансный радиус кавитациоиного пузырька примерно 3 мкм, что соизмеримо с усредненным радиусом форменных элементов крови. Кавитационных пузырьков при этих условиях намного меньше, чем клеток в суспензии, и кавитация не вносит значительных возмущений в светорассеяние,
В устойчивом режиме ка витации обусловленное ею светорассеяни е не меняется во времени, и поправка сводится к сдвигу всех мгновенных значений ординат экспериментальной крив ой на величину, обусловленную кавитацио нным светорассеянием
(рис. 2.13, б).
Нормированная ультразвуковая цитолизограмма в интегральной ф орме соответствует распределению изучаемых клеток по механической резистентности .
Интегральную ультразвуковую цитолизограмму дифференцируют и анализируют па наличие локальных экстремумов. Если таких экстремумов нет, то цитолизограмму можно представить в аналитическом виде:

где  - показания регистратора в момент измерения;
- показания регистратора в момент измерения;
 - показания регистратора в конце измерений, когда светорассеяние перестает изменяться, характеризуя окончание процесса.
- показания регистратора в конце измерений, когда светорассеяние перестает изменяться, характеризуя окончание процесса.
Параметры  и Т находят методом наименьших квадратов, спрямляя экспериментальную кривую в полулогарифмических координатах:
и Т находят методом наименьших квадратов, спрямляя экспериментальную кривую в полулогарифмических координатах:
Если предэкспоненциальный множитель bo = 1 (в пределах ошибки измерения), то ультразвуковая цитолизограмма имеет вид простой экспоненты, описывается приведенным выражением и может быть полностью охарактеризована постоянной времени Т.
Если же величина 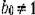 , то цитолизограмма имеет более сложный характер и определяется выражение м:
, то цитолизограмма имеет более сложный характер и определяется выражение м:
при условии, что сумма коэффициентов 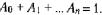
Ультразвуковые цитолиз ограммы в основном можно условно разделить на четыре типа.
•Если цитолизограмма имеет вид экспоненты, то, учитывая чисто вероятностный характер процесса ультразвукового лизиса, можно полагать, что все клетки исследуемого образца равнозначны по механической резистентности, которая пропорциональна постоянной времени (Т) экспоненты.
•Если цитолизограмма апроксимируется суммой экспонент, то, вероятно, исследуемая популяция клеток неодн ородна по механической резистентности и представляет собой совокупность нескольки х групп, внутри которых клетки равнозначны. В этом случае каждый из предэкспоненциальных множителей  равен относител ьной концентрации клеток в данной группе. Механическая резистентность клеток в каждой группе может быть охарактеризована постоянной времени для этой группы
равен относител ьной концентрации клеток в данной группе. Механическая резистентность клеток в каждой группе может быть охарактеризована постоянной времени для этой группы  .
.
Время, за которое происходит полный лизис характеризует усредн енную механическую резистентность клеток в обоих вышеприведенных случаях. В первом случае информативность параметров и  равнозначна, во втором необходимо учитывать, что на параметре Т не отр ажается неоднородность исследуемой популяции клеток.
равнозначна, во втором необходимо учитывать, что на параметре Т не отр ажается неоднородность исследуемой популяции клеток.
При сравнительном анализе удобно пользоваться тремя параметрами - 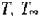 и bo. Степень отклонения bo от единицы характеризует неоднородность исследуемой популяции клеток, а увеличение Т или
и bo. Степень отклонения bo от единицы характеризует неоднородность исследуемой популяции клеток, а увеличение Т или  свидетельствует о возрастании усредненной механической резистентности клеточных мембран.
свидетельствует о возрастании усредненной механической резистентности клеточных мембран.
•Явно не экспоненциальный характер цитолизограммы, как правило, связан со спонтанным лизисом клеток, либо с методическими ошибками (например, с неправильным определением начала процесса).
•Неполный при данных условиях ультразвуковой лизис свидетельствует либо о присутствии в образце группы клеток с аномально высокой механической резистентностью, либо о незавершенности процесса лизиса.
Анализ результатов ультразвукового цитолизиса удобно проводить с использованием компьютера.
При подборе оптимальных значений: начальной концентрации клеток и суспензии, ее температуры, средней плотности энергии в ультразвуковом поле и пр. - можно подобрать условия, варьирование которых в определенных пределах мало влияет на воспроизводи- мость, точность и информативность конечного результата.
Для определения оптимальных условий ультразвукового цитолизиса была исследована динамика ультразвукового разрушения тромбоцитов, эритроцитов, лейкоцитов ряда животных при изменении начальных концентраций клеток (турбодиметрическое ослабление в пределах 0,1-1,2) и при плотности энергии ультразвука 0,04...0,13 Вт/см3.
Исследование проводили при температуре 24°С, так как в интервале 22...28°С характер ультразвуковых цитолизограмм практически не зависит от температуры. Было установлено, что при 100%-ном ультразвуковом лизисе относительное турбидиметрическое ослабление для эритроцитов принимает значение 14-15, для лейкоци- тов - 12-14, для кровяных пластинок - 10-12. Порог кавитации при повышении концентрации эритроцитов и лейкоцитов в суспензии до значений, соответствующих турбидиметрическому ослаблению, - 1,2 (для тромбоцитов 0,9) оставался в пределах
0,04...0,05 Вт/см3.
Турбидиметрическое ослабление, обусловленное кавитацией, через 1...2 с после се возникновения устанавливается па постоянном уровне, практически не зависит от концентрации клеток в суспензии и составляет 0,01-0,05 (в зависимости от интенсивности ультразвука) при 540...750 нм. Для форменных элементов крови различного проис- хождения динамика ультразвукового лизиса максимально различается при плотности энергии 0,04 Вт/см3. При 0,08...0,09 Вт/см3 различия существенно уменьшаются вплоть до полной нивелировки. Однако ошибка воспроизводимости метода в соответствии с оценкой по двум параметрам (время 50 %-иого и 100 %-ного лизиса) при плотности энергии 0,04 Вт/см3 в некоторых случаях достигает 40 %. При увеличении плотности энергии до 0,05..,0,06 Вт/см3 ошибка воспроизводимости снижается до 5 %,
Для каждого типа клеток при всех исследованных плотностях энергии в поле ультразвука существует область достаточно малых концентраций клеток, в которой динамика ультразвукового цитолизиса практически не зависит от концентрации (табл. 2.1).
Таблица 2.1

Концентрация клеток (но турбидиметрическому ослаблению), при которой динамика ультразвукового цитолизиса не зависит от плотности ультразвуковой энергии
|
Плотность энергии |
|
|
|
Тип клепок |
ультразвука, |
|
|
|
|
Вт/см3 |
|
|
|
0,05 |
0,06 |
0,08 |
0,0 |
|
|
|
|
9 |
|
Эритроциты 0,6 |
0,6 |
0,65 |
0,7 |
|
Лейкоциты |
0,35 |
0,4 |
0,5 |
0,55 |
Тромбоциты 0,5 |
0,6 |
0,8 |
0,8 |
|
Во всех случаях для ультразвуковой цитолизометрии оптимальной является средняя плотность ультразвуковой энергии, равная 0,05 Вт/см3, которую можно обеспечить, излучая в кювету объемом 8 см3 звук с интенсивностью 0,4 Вт/см2. Оптимальная концентрация клеток в исследуемой суспензии соответствует величине начального турбидиметрического ослабления 0,2-0,35. При более высокой концентрации клеток усложняется интерпретация экспериментальных кривых, так как приходится учитывать поправки на нелинейность фотоэлектрической регистрации турбидиметрического ослабления. При более низких начальных концентрациях клеток снижается чувствительность метода и возникает необходимость введения поправок на светорассеяние кавитационными пузырьками. Началом процесса следует считать момент возникновения кавитации в жидкости, а цитолизис проводить при температуре 24 °С.
При выполнении указанных условий ультразвуковая цитолизометрия может быть успешно применена при диагностике ряда заболеваний, а также для оценки изменений свойств клеточных мембран при консервировании, гемосорбции, гемодиализе и других манипуляциях с клетками в суспензии.
До последнего времени систематических исследований механической прочности эритроцитов не проводилось, и лишь недавно были получены данные об ультразвуковой резистентности мембран эритроцитов человека, а также лошади, быка, коровы, пони, овцы, козы, свиньи, собаки, лисы, песца, кролика, курицы, морской свинки, белой крысы, белой мыши и др. (рис. 2.14).
Ультразвуковая резистентность эритроцитов заменю различается у животных разных видов в зависит от массы их тела, возрастая с увеличением последней в виде показательной функции
где R - резистентность эритроцитов;
М масса тела животных.

Рис. 2.14, Зависимость ультразвуковой резистентности эритроцитов от массы тела животных и человека:
1 - белая мышь; 2 - белая крыса; 3 - морская свинка; 4 - курица; 5 - кролик; 6 - песец; 7 - лиса; 8 - собака; 9 - коза; 10 овца; 11 - свинья; 12 человек; 13 - пони; 14 - корона; 15 - лошадь; 16 - бык
Показатель степени отра жает характер изменения ультразвуковой резистентности с изменением массы тела. Этот показатель меньше единицы. Отсюда следует, что в ряду близких видов или в проц ессе роста ультразвуковая резистентност ь эритроцитов увеличи- вается медленнее, чем масса тела животных.
Поиск причин зависимости ультразвуковой резистентности от массы тела показал, что, по крайней мере, у исследованных видов эритроциты за время своего существования делают примерно одинаковое чи сло оборотов в кровяном русле, а время одного полного оборота уменьшается с уменьшением размера и массы животного (табл. 2.2). Соответственно уменьшается и длина пути, проходимого эритроцитами за время одного оборота. Средине числа оборотов за время существования эритроцитов и время одного полного оборота были рассчитаны, исходя из данных о полном объеме крови, минутном объеме сердца и времени жизни эритроцитов соответствующих животных.
Таблица 2.2
Масса тела и некоторые п араметры кровообращения теплокровных
Животные и |
Масса тела, |
Цикл кровообращения, |
Количество циклов |
|
человек |
кг. |
с |
эритроцитов |
|
Бык |
620 |
36,8 |
2,8 |
- 105 |
Лошадь |
570 |
39,7 |
2,9 |
- 105 |
Корова |
560 |
35,2 |
2,7 |
- 105 |
Пони |
150 |
- |
— |
|
Человек |
G5 |
31,7 |
2,7 |
105 |
Свинья |
50 |
27,7 |
2,7 |
- 105 |
Овца |
47 |
28,3 |
2,9 |
105 |
Коза |
44 |
26,3 |
2,8 |
- 105 |
Собака |
40 |
25,6 |
2,7 |
-10 5 |
Лиса |
7 |
- |
- |
|
Песец |
6 |
- |
- |
|
Кролик |
2,5 |
17,5 |
2,5 |
- 105 |
Курица |
2,4 |
12,1 |
2,2 |
-105 |
Морская свинка |
0,29 |
14,4 |
3,4 |
-105 |
Белая крыса |
0,2 |
12,5 |
3,0 |
- 105 |
Белая мышь |
0,03 |
7,9 |
3,1 |
- 105 |
Поскольку число оборотов эритроцитов за время их существования у всех видов животных примерно одинаково, то у мелких животных эритроциты за время их существования проходят значительно меньший путь, чем у животных крупных размеров.
По-видимому, это одна из причин, обусловливающих необходимость в более высокой механической прочности мембран эритроцитов крупных животных, так как в кровяном русле, в особенности в узких капиллярах, эритроциты подвергаются значительным механическим воздействиям. Прямая пропорциональность между ультразвуковой резистентностью эритроцитов и средним временем их полного обращения свидетельствует в пользу данного предположения. Возможно, прочность мембраны зависит от содержания в ней холестерина и сфингомиелина, увеличивающегося с увеличением массы животного при соответствующем уменьшении количества фосфатидилэтаноламина и фосфатидилхолина в мембранах.
Сравнивая зависимость, отображенную на рис. 2.14, с известной кривой «от мыши до слона», иллюстрирующей связь интенсивности обмена веществ с массой тела животного, можно предположить, что резистентность эритроцитов также связана с интенсивностью обменных процессов в организме.
Подтверждение этому было получено при сравнении скорости ультразвукового гемолиза эритроцитов животных одного вида, но находящихся в разных условиях. Так, эритроциты стриженой овцы менее устойчивы к ультразвуковому воздействию, чем эритроциты овцы, покрытой шерстью, У коз, обитающих в горах, стойкость эритроцитов выше, чем у коз, живущих в равнинной местности.
Сравнение прочности эритроцитов овцы и барана, быка и коровы, мужчины и женщины показало, что у особей женского пола ультразвуковая резистентность эритроцитов в 1,2 раза ниже, чем у особей мужского пола (рис. 2.15), Интересно отметить, что прочность эритроцитов барана после кастрации постепенно уменьшается и через 80 дней лишь незначительно превосходит прочность эритроцитов овец.
Характерные изменения в ультразвуковых эритрограммах человека и животных можно наблюдать при различных физиологических состояниях и патологиях. При циррозе печени циркулирующие в крови эритроциты частично повреждаются токсическими продуктами, которые насыщают кровь вследствие функциональной несостоятельности печени. На эритрограмме коров с циррозом печени наблюдается снижение стойкости всей массы клеток. Такая картина наиболее характерна при циррозе с выраженной недоста- точностью клеток паренхимы. Аналогичные по характеру изменения наблюдаются при фасциолезе - паразитарном заболевании печени домашних и диких животных. Выделяемые паразитом продукты жизнедеятельности оказывают влияние на ткани печени, вызывающие гепатиты и циррозы.

При лейкозах обнаружено повышение ультразвуковой резистентности лейкоцитов и эритроцитов, что объясняется пополнением крови формами клеток, обладающих повышенной прочностью клеточных мембран.
При заболеваниях воспалительного характера, таких, как пневмонии, эндометриты, маститы, обнаружено увеличение содержания в крови клеток с пониженной ультразвуковой резистентностью.
Рис. 2.15. Зависимость ультразвуковой рэзистености эритроцитов теплокровных от их пола к условий сущесгвования: 1 горная коза;2 -равнинная коза;3- овца, покрытая шерстью; 4 - стриженая овца; 5 - мужчина; 6 - женщина
Характерные изменения на эритрограммах животных наблюдаются и при диспепсиях, кетозах и других заболеваниях. Изменяются эритрограммы в зависимости от условий содержания и кормления животных, в том числе домашней птицы.
Ультразвуковая резистентность эритроцитов 15-дневных эмбрионов кур коррелирует с инкубационным качеством яйца, причем повышение выводимости благодаря доинкубационной обработке яиц стимуляторами - парааминобензойной кислотой, хлорно- кислым аммонием или ультразвуком низких интенсивностей соответственно изменяет и ультразвуковую резистентность эритроцитов эмбрионов,
В условиях загрязнения окружающей среды промышленными отходами представляет интерес возможность оценки состояния рыб при ртутном отравлении по скорости разрушения их эритроцит ов в ультразвуковом поле. Предварительн о было показано, что некоторые отличия в стро ении эритроцитов рыб не являются препятствием для ис- пользования метода ультразвукового гемолиза.
Исследования показали, что скорость гемолиза эритроцитов рыбы, обитающей в среде, содержащей препараты ртути, со временем увеличивается, причем скорость ультразвукового гемолиза прямо пропорциональна концентрации ртути, накапливающейся в печени рыбы.
Разработанный вначале для ветеринарных целей метод ультразвуко вого цитолизиса оказался весьма полезны м и в медицинской практике. Так, в результате исследования крови клинически здоровых людей обоего пола в возрасте 15-60 лет было установлено, что параметры, характери зующие ультразвуковую резистентность эритроцитов в норме, стабильны. Эта стабильность, очевидно, обусловлена действием фи зиологических механизмов, поддерживающих динамическое равновесие в качественном составе красной
крови. Ультразвуковая резистентность эритроцитов в пределах 15-60 лет мало зависит от возраста доноров, тогда как химическая стойкость эритроцитов подвержена существенным возрастным изменениям.
Исследование эритроцитов больных выявило существенные различия в параметрах, характеризующих ультразвуковой гемолиз в норме и при опухолях. Так, полное время гемолиза эритроцитов здоровых допоров составило (485 ± 10) с, при раке молочной железы - (617 ± 30) с, при раке желудка - (603 ± 40) с, при раке легких - (555 ± 40) с и при лимфогранулематозе - (735 ± 67) с.
При опухолях ультразвуковая резистентность эритроцитов и, следовательно, их механическая стойкость заметно увеличиваются но сравнению с нормой. Аналогичные данные были получены при лейкозах крупного рогатого скота, при спонтанных опухолях у собак, при привитой под колено взрослым крысам карциноме РС-1.
Благоприятно протекающий процесс лечения опухолевого заболевания сопровождается снижением прочности мембран эритроцитов, вплоть до значений, характеризующих норму, и чем эффективнее лечение, тем быстрее стремится к норме ультразвуковая резистентность эритроцитов. Очевидно, что быстрое снижение резистентности эрит- роцитов до нормы можно ожидать также при удачной хирургической операции и незначительные изменения этого параметра при неполном иссечении опухоли или ее метастазов.
Различия в количестве разрушенных эритроцитов наблюдались ранее при ультразвуковой обработке (830 кГц; 0,2...0,8 Вт/см2; 5 мин) разбавленной в 10 раз крови здоровых животных и животных с гипотиреозом и экспериментальным диабетом. Резистентность эритроцитов человека к низкочастотному ультразвуковому воздействию (24 кГц, 60 Вт) при некоторых заболеваниях крови также существенно отличается от нормы. Так, при серповидной анемии и с фероцитозе устойчивость эритроцитов к ультразвуку оказалась заметно повышенной, тогда как дефицит железа в организме приводит к уменьшению стойкости клеток красной крови.
Метод ультразвуковых цитолизограграмм успешно использован и для оценки качества эритроцитов, консервированных при пониженных (+4оС) и низких (-196 °С) температурах. Ультразвуковая резистентность эритроцитов, хранящихся при +4 скачкообразно уменьшается на 4-й и 17-й день хранения, после чего остается практически неизменной, вплоть до 22 суток хранения. Этот результат хорошо согласуется с известными данными об увеличении скорости спонтанного гемолиза в эти сроки. На ультразвуковых эритрограммах, полученных на 4-й и 17-й день хранения, ясно видны различия в распределении эритроцитов по группам стойкости, выражающиеся в увеличении количества менее стойких к ультразвуковому воздействию клеток.
Консервирование эритроцитов при -196°С под комплексной защитой полиэтиленоксида с молекулярным весом 1500 и димстилацетамида, обладающих» соответственно, и экстра- и интрацеллюлярным действием, приводит к изменению распределения клеток по прочности, к увеличению числа более прочных эритроцитов. По-видимому, криофилактики оказывают стабилизирующее действие на клеточные мембраны. Судя по ультразвуковым эритрограммам, эритроциты, хранившиеся в течение 5 лет при температуре -196 °С под защитой глицерина 35%-ной концентрации, лучше переносят хранение, чем эритроциты, хранившиеся в среде, где концентрация глицерина не превышала 30 %. Это хорошо согласуется с известным фактом, что криозащитное дейст- вие глицерина в определенных пределах пропорционально его концентрации в среде.
